Syndrome de Wolff-Parkinson-White - Wolff–Parkinson–White syndrome
| Syndrome de Wolff-Parkinson-White | |
|---|---|
| Autres noms | Schéma WPW, pré-excitation ventriculaire avec arythmie, syndrome de la voie accessoire auriculo-ventriculaire |
 | |
| Une "onde delta" caractéristique (flèche) observée chez une personne atteinte du syndrome de Wolff-Parkinson-White. Notez le court intervalle PR . | |
| Spécialité | Cardiologie |
| Symptômes | Battements cardiaques anormalement rapides , palpitations , essoufflement , étourdissements, perte de conscience |
| Complications | Cardiomyopathie , accident vasculaire cérébral , mort subite cardiaque |
| Début habituel | Naissance |
| Causes | Voie accessoire dans le coeur |
| Méthode de diagnostic | L'électrocardiogramme montre un intervalle PR court et un large complexe QRS à partir d'une onde delta |
| Traitement | Attente sous surveillance , médicaments, ablation par cathéter radiofréquence |
| Pronostic | Sans symptômes 0,5% (enfants), 0,1% (adultes) risque de décès par an |
| La fréquence | 0,2% |
Le syndrome de Wolff-Parkinson-White ( WPWS ) est un trouble dû à un type spécifique de problème du système électrique du cœur qui a entraîné des symptômes. Environ 40% des personnes ayant un problème électrique ne développent jamais de symptômes. Les symptômes peuvent inclure un rythme cardiaque anormalement rapide , des palpitations , un essoufflement , des étourdissements ou une syncope . Rarement, un arrêt cardiaque peut survenir. Le type de rythme cardiaque irrégulier le plus courant est connu sous le nom de tachycardie supraventriculaire paroxystique .
La cause de la WPW est généralement inconnue et est probablement due à une combinaison de facteurs aléatoires et génétiques. Un petit nombre de cas sont dus à une mutation du gène PRKAG2 qui peut être héritée des parents d'une personne sur un mode autosomique dominant . Le mécanisme sous-jacent implique une voie de conduction électrique accessoire entre les oreillettes et les ventricules . Elle est associée à d'autres affections telles que l' anomalie d'Ebstein et la paralysie périodique hypokaliémique . Le diagnostic de WPW survient avec une combinaison de palpitations et lorsqu'un électrocardiogramme (ECG) montre un intervalle PR court et une onde delta. C'est un type de syndrome de pré-excitation .
Le syndrome de WPW peut être surveillé ou traité avec des médicaments ou une ablation (détruisant les tissus) comme l'ablation par cathéter par radiofréquence . Elle touche entre 0,1 et 0,3% de la population. Le risque de décès chez les personnes sans symptômes est d'environ 0,5% par an chez les enfants et de 0,1% par an chez les adultes. Dans certains cas, une surveillance non invasive peut aider à stratifier plus soigneusement les risques des patients dans une catégorie à risque inférieur. Chez les personnes sans symptômes, une observation continue peut être raisonnable. Chez les personnes atteintes de WPW compliquée de fibrillation auriculaire , la cardioversion ou le médicament procaïnamide peuvent être utilisés. La condition porte le nom de Louis Wolff , John Parkinson et Paul Dudley White qui ont décrit les résultats de l'ECG en 1930.
Signes et symptômes
Les personnes atteintes de WPW sont généralement asymptomatiques lorsqu'elles n'ont pas une fréquence cardiaque rapide. Cependant, les individus peuvent éprouver des palpitations , des étourdissements , un essoufflement ou rarement une syncope (évanouissement ou quasi-évanouissement) au cours d'épisodes de tachycardie supraventriculaire . Le WPW est également associé à un très faible risque de mort subite en raison de troubles du rythme cardiaque plus dangereux.
Physiopathologie
L'activité électrique dans le cœur humain normal commence lorsqu'un potentiel d'action cardiaque apparaît dans le nœud sino - auriculaire (SA), qui est situé dans l' oreillette droite . De là, le stimulus électrique est transmis via des voies internodales au nœud auriculo - ventriculaire (AV). Après un bref délai au nœud AV, le stimulus traverse le faisceau de His vers les branches gauche et droite du faisceau, puis vers les fibres de Purkinje et l' endocarde au sommet du cœur, puis enfin vers le myocarde ventriculaire .
Le nœud AV remplit une fonction importante en tant que « garde-porte », limitant l'activité électrique qui atteint les ventricules. Dans les situations où les oreillettes génèrent une activité électrique excessivement rapide (comme la fibrillation auriculaire ou le flutter auriculaire ), le nœud AV limite le nombre de signaux acheminés vers les ventricules. Par exemple, si les oreillettes sont activées électriquement à 300 battements par minute, la moitié de ces impulsions électriques peuvent être bloquées par le nœud AV, de sorte que les ventricules sont stimulés à seulement 150 battements par minute, ce qui donne une impulsion de 150 battements par minute. Une autre propriété importante du nœud AV est qu'il ralentit les impulsions électriques individuelles. Cela se manifeste sur l'électrocardiogramme comme l' intervalle PR (le temps entre l'activation électrique des oreillettes et l'activation électrique des ventricules ), qui est généralement raccourci à moins de 120 millisecondes .
Les personnes atteintes de WPW ont une voie accessoire qui communique entre les oreillettes et les ventricules, en plus du nœud AV. Cette voie accessoire est connue sous le nom de faisceau de Kent. Cette voie accessoire ne partage pas les propriétés de ralentissement du rythme du nœud AV et peut conduire une activité électrique à un rythme nettement plus élevé que le nœud AV. Par exemple, dans l'exemple ci-dessus, si un individu avait une fréquence auriculaire de 300 battements par minute, le faisceau accessoire peut conduire toutes les impulsions électriques des oreillettes vers les ventricules, provoquant la contraction des ventricules à 300 battements par minute. Des rythmes cardiaques extrêmement rapides comme celui-ci peuvent entraîner une instabilité hémodynamique ou un choc cardiogénique . Dans certains cas, la combinaison d'une voie accessoire et de rythmes cardiaques anormaux peut déclencher une fibrillation ventriculaire , l'une des principales causes de mort subite d'origine cardiaque.
WPW peut être associé à PRKAG2 , une enzyme protéine kinase codée par le gène PRKAG2 .
Paquet de Kent

Le faisceau de Kent est une voie de conduction anormale supplémentaire ou accessoire entre les oreillettes et les ventricules qui est présente dans un faible pourcentage (entre 0,1 et 0,3 %) de la population générale. Cette voie peut communiquer entre l'oreillette gauche et le ventricule gauche, auquel cas elle est appelée « pré-excitation de type A », ou entre l'oreillette droite et le ventricule droit, auquel cas elle est appelée « pré-excitation de type B ». excitation". Des problèmes surviennent lorsque cette voie crée un circuit électrique qui contourne le nœud AV. Le nœud AV est capable de ralentir la vitesse de conduction des impulsions électriques vers les ventricules, alors que le faisceau de Kent n'a pas cette capacité. Lorsqu'une connexion électrique aberrante est réalisée via le faisceau de Kent, des tachydysrythmies peuvent donc en résulter.
Diagnostic

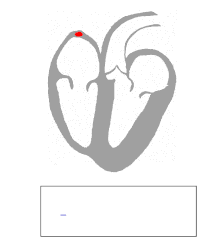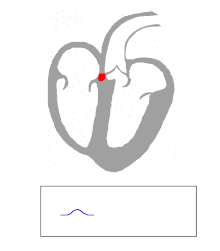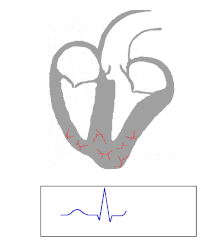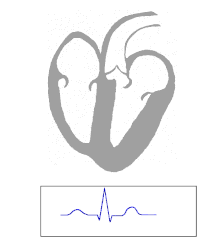
WPW est généralement diagnostiqué sur la base de l'électrocardiogramme chez un individu asymptomatique. Dans ce cas, il se manifeste sous la forme d'une onde delta, qui est un mouvement ascendant dans le complexe QRS associé à un intervalle PR court. L'intervalle PR court et l'obstruction du complexe QRS reflètent l'impulsion qui arrive tôt dans les ventricules (via la voie accessoire) sans le retard habituel ressenti dans le nœud AV.
Si une personne avec WPW éprouve des épisodes de fibrillation auriculaire, l'ECG montre une tachycardie polymorphe rapide à complexe large (sans torsades de pointes ). Cette combinaison de fibrillation auriculaire et de WPW est considérée comme dangereuse et la plupart des médicaments antiarythmiques sont contre-indiqués.
Lorsqu'un individu est en rythme sinusal normal , les caractéristiques ECG du WPW sont un intervalle PR court (durée inférieure à 120 millisecondes), un complexe QRS élargi (durée supérieure à 120 millisecondes) avec une remontée du complexe QRS et une repolarisation secondaire changements (reflétés dans le segment ST - changements d' onde T ).
Chez les personnes atteintes de WPW, l'activité électrique qui est initiée dans le nœud SA se déplace à travers la voie accessoire, ainsi que par le nœud AV pour activer les ventricules via les deux voies. Étant donné que la voie accessoire n'a pas les propriétés de ralentissement des impulsions du nœud AV, l'impulsion électrique active d'abord les ventricules via la voie accessoire, et immédiatement après via le nœud AV. Cela donne l'intervalle PR court et la montée en suspension du complexe QRS connu sous le nom d'onde delta.
En cas de pré-excitation de type A (connexions auriculo-ventriculaires gauches), une onde R positive est vue en V1 (« delta positif ») sur les dérivations précordiales de l'électrocardiogramme, tandis qu'en pré-excitation de type B (connexions auriculo-ventriculaires droites), une une onde delta principalement négative est observée dans la dérivation V1 (« delta négatif »).
Les personnes atteintes de WPW peuvent avoir plus d'une voie accessoire - dans certains cas, jusqu'à huit voies anormales ont été trouvées. Cela a été observé chez des personnes atteintes de l'anomalie d' Ebstein .
Le syndrome de Wolff-Parkinson-White est parfois associé à la neuropathie optique héréditaire de Leber , une forme de maladie mitochondriale .
Stratification des risques
WPW comporte un faible risque de mort subite, probablement en raison d'une fibrillation auriculaire rapidement conduite provoquant une fibrillation ventriculaire. Alors que le risque global est d'environ 2,4 pour 1000 personnes-années, le risque chez un individu dépend des propriétés de la voie accessoire provoquant la pré-excitation.
Une voie accessoire à risque plus élevé peut être suggérée par des antécédents de syncope, mais la stratification du risque est mieux réalisée en évaluant la fréquence à laquelle une voie peut conduire une impulsion vers les ventricules, généralement via une stimulation électrique programmée (SPE) dans le laboratoire d' électrophysiologie cardiaque . Il s'agit d'une procédure invasive mais généralement à faible risque au cours de laquelle les oreillettes sont stimulées pour tenter d'induire une tachycardie. Si une tachycardie impliquant la voie accessoire peut être déclenchée, le cardiologue peut alors évaluer à quelle vitesse la voie accessoire est capable de conduire. Plus il peut conduire rapidement, plus la probabilité que la voie accessoire puisse conduire assez rapidement pour déclencher une tachycardie mortelle est élevée.
Les caractéristiques à haut risque pouvant être présentes au cours de l'EPS comprennent une période réfractaire efficace de la voie accessoire inférieure à 250 ms, des voies multiples, une localisation septale de la voie et l'inductibilité de la tachycardie supraventriculaire ( AVRT , fibrillation auriculaire). Les personnes présentant l'une de ces caractéristiques à haut risque sont généralement considérées comme présentant un risque accru de drépanocytose ou de tachycardie symptomatique, et doivent être traitées en conséquence (c.-à-d. ablation par cathéter).
Il n'est pas clair si la stratification du risque invasif (avec PES) est nécessaire chez l'individu asymptomatique. Alors que certains groupes préconisent le PES pour la stratification du risque chez tous les individus de moins de 35 ans, d'autres ne le proposent qu'aux individus ayant des antécédents évocateurs d'une tachydysrythmie, car l'incidence de la mort subite d'origine cardiaque est si faible (moins de 0,6 % dans certains rapports).
D'autres méthodes de stratification du risque comprennent l'observation de la fréquence ventriculaire pendant la fibrillation auriculaire spontanée sur un ECG à 12 dérivations. Des intervalles RR inférieurs à 250 ms suggèrent une voie à risque plus élevé. Pendant l'épreuve d'effort, une perte brutale de pré-excitation à mesure que la fréquence cardiaque augmente suggèrent également une voie à risque plus faible. Cependant, cette approche est entravée par l'amélioration normale de la conduction du nœud AV pendant l'exercice qui peut également masquer la pré-excitation malgré la conduction continue le long de la voie accessoire.
Traitement
Les personnes atteintes de WPW qui présentent des rythmes cardiaques anormaux rapides ( tachydysrythmies ) peuvent nécessiter une cardioversion électrique synchronisée si elles présentent des signes ou des symptômes graves (par exemple, une pression artérielle basse ou une léthargie avec un état mental altéré ). S'ils sont relativement stables, des médicaments peuvent être utilisés.
Médicaments
Les personnes atteintes de fibrillation auriculaire et de réponse ventriculaire rapide peuvent être traitées avec de l' amiodarone ou de la procaïnamide pour stabiliser leur fréquence cardiaque. La procaïnamide et la cardioversion sont des traitements acceptés pour la conversion de la tachycardie trouvée avec WPW. L'amiodarone dans la fibrillation auriculaire avec WPW est liée à la fibrillation ventriculaire et peut donc être pire que la procaïnamide.
Les bloqueurs des nœuds AV doivent être évités en cas de fibrillation auriculaire et de flutter auriculaire avec WPW ou antécédents de celui-ci ; cela comprend l' adénosine , le diltiazem , le vérapamil , d'autres inhibiteurs calciques et les bêta-bloquants . Ils peuvent exacerber le syndrome en bloquant la voie électrique normale du cœur (favorisant ainsi la conduction 1:1 atriale-ventricule par la voie de pré-excitation, conduisant potentiellement à des arythmies ventriculaires instables).
Ablation par cathéter
Le traitement définitif de la WPW est la destruction de la voie électrique anormale par ablation par cathéter . Deux principaux types d'ablation par cathéter sont la cryoablation (à froid) ou l'ablation par radiofréquence (à chaud). Cette procédure est réalisée par des électrophysiologistes cardiaques. Lorsqu'elle est effectuée par un électrophysiologiste expérimenté, l'ablation par radiofréquence a un taux de réussite élevé. Les résultats de 1994 indiquent des taux de réussite allant jusqu'à 95 % chez les personnes traitées par ablation par cathéter par radiofréquence pour WPW. Si l'ablation par cathéter par radiofréquence est effectuée avec succès, la condition est généralement considérée comme guérie. Les taux de récidive sont généralement inférieurs à 5% après une ablation réussie. La seule mise en garde est que les personnes atteintes d'une anomalie d'Ebstein sous-jacente peuvent avoir plusieurs voies accessoires en raison de leur cardiopathie congénitale sous-jacente.
Histoire
Le faisceau de Kent porte le nom éponyme du physiologiste britannique Albert Frank Stanley Kent (1863-1958), qui a décrit des branches latérales dans le sillon auriculo-ventriculaire du cœur de singe (croyant à tort qu'elles constituaient le système de conduction auriculo-ventriculaire normal).
En 1915, Frank Norman Wilson (1890-1952) est devenu le premier à décrire la maladie appelée plus tard syndrome de Wolff-Parkinson-White. Alfred M. Wedd (1887-1967) a été le suivant à décrire la maladie en 1921. Les cardiologues Louis Wolff (1898-1972), John Parkinson (1885-1976) et Paul Dudley White (1886-1973) sont crédités de la description définitive du désordre en 1930.
Cas notables
- LaMarcus Aldridge , basketteur américain
- Michael Cera , acteur canadien
- Nathan Eagleton , ancien joueur de football australien
- Jeff Garlin , acteur, écrivain et comédien américain
- Quentin Groves , joueur de football américain décédé d'une crise cardiaque à l'âge de 32 ans
- Dan Hardy , combattant britannique des poids mi-moyens de l' UFC , devenu analyste et commentateur
- Alicia Hoskin , canoéiste olympique néo-zélandaise.
- Mitch Hurwitz , scénariste et producteur de télévision américain, créateur de Arrested Development
- Jessie J , musicienne britannique
- Marilyn Manson , musicienne, peintre et actrice américaine
- Meat Loaf , musicien américain
- Michael Rupp , américain de hockey sur glace joueur
- Montel Vontavious Porter , lutteur professionnel
- Michael Montgomery , joueur de football américain
Voir également
Les références
Liens externes
- Syndrome de Wolff-Parkinson-White à Curlie
- Référence à la maison de la génétique : syndrome de Wolff-Parkinson-White ( Bibliothèque nationale de médecine des États-Unis , Bethesda, Maryland)
- Clinique du syndrome de Wolff-Parkinson-White, Université du Wisconsin - Madison
| Classification | |
|---|---|
| Ressources externes |


