Sel acide - Acid salt
Les sels acides sont une classe de sels qui produisent une solution acide après avoir été dissous dans un solvant . Sa formation en tant que substance a une conductivité électrique supérieure à celle du solvant pur. Une solution acide formée par un sel d'acide est préparée lors de la neutralisation partielle des acides diprotiques ou polyprotiques . Une demi-neutralisation se produit en raison du reste des atomes d' hydrogène remplaçables de la dissociation partielle d'acides faibles qui n'ont pas réagi avec des ions hydroxyde ( OH - ) pour créer des molécules d'eau. Le sel d'acide est un composé ionique composé d'un anion, apporté par un acide parent faible , et d'un cation, apporté par une base parent forte .
Solution acide et exemples de sels d'acide
La propriété acide-base de la solution résultante d'une réaction de neutralisation dépend des produits salins restants. Un sel contenant des cations réactifs subit une hydrolyse par laquelle ils réagissent avec les molécules d'eau, provoquant la déprotonation des acides conjugués.
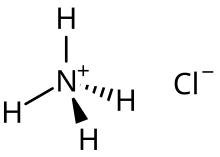
Par exemple, le sel d' acide chlorure d'ammonium est la principale espèce formée lors de la demi-neutralisation de l'ammoniac en solution d'acide chlorhydrique:
| Identité: | Bisulfate de sodium | Phosphate monosodique | Phosphate disodique |
|---|---|---|---|
| Formule structurelle | |||
| Formule chimique |
NaHSO 4 |
NaH 2 PO 4 |
N / A 2 HPO 4 |
| Nom IUPAC | Hydrogénosulfate de sodium | Phosphate monosodique | Hydrogénophosphate disodique |
| Autre nom | |||
| Masse moléculaire | 120,054 g / mol | 119,976 g / mol | 141,957 g / mol |
| Charge formelle | zéro | zéro | zéro |
| Odeur | Inodore | Inodore | Inodore |
| Apparence | Cristaux ou granules blancs | Poudre cristalline blanche | Poudre hygroscopique blanche |
| Structure | Cristaux monocliniques | Cristaux monocliniques (anhydres) | |
| Solubilité | |||
|
Densité |
0,5 à 1,2 g / cm 3 | 1,7 g / cm 3 | |
|
Décomposition (par chauffage) |
Forme du carbonate de sodium, de l'eau et du dioxyde de carbone | Émet des fumées toxiques de phosphoxydes et d'oxyde de sodium | Émet des fumées toxiques d'oxydes de phosphore et de sodium |
| Les usages |
Utilisation dans les aliments
Les sels acides sont souvent utilisés dans les aliments dans le cadre d'agents levants. Dans ce contexte, les sels d'acide sont appelés «acides levants». Les acides levants courants comprennent la crème de tartre et le phosphate monocalcique .
Un sel acide peut être mélangé avec un sel alcalin (tel que le bicarbonate de sodium ou le bicarbonate de soude) pour créer des poudres à pâte qui libèrent du dioxyde de carbone . Les agents levants peuvent être à action lente (par exemple le phosphate de sodium et d'aluminium ) qui réagissent lorsqu'ils sont chauffés, ou à action rapide (par exemple, crème de tartre) qui réagissent immédiatement à basse température. Les poudres à pâtisserie à double action contiennent des agents levants à action lente et rapide et réagissent à des températures basses et élevées pour fournir une levée levante tout au long du processus de cuisson.
Phosphate disodique , Na
2 HPO
4 , est utilisé dans les aliments et le phosphate monosodique, NaH
2 PO
4 , est utilisé dans l'alimentation animale, le dentifrice et le lait évaporé.
Intensité de l'acide
Un acide avec une valeur K plus élevée domine la réaction chimique. Il sert de meilleur contributeur de protons ( H + ). Une comparaison entre K a et K b indique la propriété acido-basique de la solution résultante par laquelle:
- La solution est acide si K a > K b . Il contient une plus grande concentration d' ions H + que la concentration d' ions OH - en raison d'une hydrolyse cationique plus étendue que celle de l'hydrolyse anionique.
- La solution est un alcali si K a < K b . Les anions hydrolysent plus que les cations, provoquant une concentration excessive d' ions OH - .
- La solution ne devrait être neutre que lorsque K a = K b .
D'autres facteurs possibles qui pourraient faire varier le niveau de pH d'une solution sont les constantes d'équilibre pertinentes et les quantités supplémentaires de toute base ou acide.
Par exemple, dans une solution de chlorure d'ammonium , NH +
4 est la principale influence de la solution acide. Il a une valeur de K supérieure à celle des molécules d'eau; K a de NH +
4 est 5,6 × 10 −10 , et K w de H
2 O est 1,0 × 10 −14 . Ceci assure sa déprotonation lors de la réaction avec l'eau, et est responsable du pH inférieur à 7 à température ambiante. Cl - n'aura aucune affinité pour H + ni tendance à s'hydrolyser, car sa valeur K b est très faible ( K b de Cl - est 7,7 × 10 -21 ).
L'hydrolyse de l'ammonium à température ambiante produit:
Voir également
- Sel alcalin
- Sel (chimie)
- Oxoacide
- Bicarbonate de sodium
- Bisulfate de sodium
- Phosphate disodique
- Phosphate monosodique
Les références





![{\ displaystyle K _ {\ mathrm {a}} = {\ frac {\ mathrm {[NH_ {3}] [H_ {3} O ^ {+}]}} {\ mathrm {[NH_ {4} ^ {+ }]}}} = {\ frac {K _ {\ mathrm {w}}} {K _ {\ mathrm {b}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5eac34ff25fa376268b6f116d33bf3d00ca7dfab)
![{\ displaystyle K _ {\ mathrm {a}} = {\ frac {[1,0 \ fois 10 ^ {- 14}]} {[1,8 \ fois 10 ^ {- 5}]}} = {5,6} \ fois 10 ^ {-dix}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/43f0025153c13e4b649bc0ef2c4ea94caefc4c28)