Acide bromeux - Bromous acid
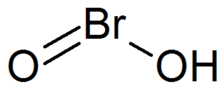
|
|

|
|

|
|
| Des noms | |
|---|---|
|
Noms IUPAC
hydroxy-λ 3 -bromanone
hydroxidooxidobromine acide bromeux |
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
|
PubChem CID
|
|
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| HBrO 2 | |
| Masse molaire | 112,911 g / mol |
| Base conjuguée | Bromite |
| Composés apparentés | |
|
Autres anions
|
Acide bromhydrique ; acide hypobromeux ; acide bromique ; acide perbromique |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Références Infobox | |
L'acide bromeux est le composé inorganique de formule HBrO 2 . C'est un composé instable, bien que des sels de sa base conjuguée - les bromites - aient été isolés. En solution acide, les bromites se décomposent en brome.
Découverte
En 1905, Richards AH a prouvé l'existence de l'acide bromique à travers une série d'expériences impliquant le nitrate d'argent (AgNO 3 ) et le brome. La réaction d'un excès aqueux froid pour former de l'acide hypobromeux (HBrO), du bromure d'argent (AgBr) et de l'acide nitrique (HNO 3 ):
- Br 2 + AgNO 3 + H 2 O → HBrO + AgBr + HNO 3
Richards a découvert que l'effet de l'ajout de brome liquide en excès dans un nitrate d'argent concentré (AgNO 3 ) entraînait un mécanisme de réaction différent. À partir du nombre de portions équivalentes de brome acide formées à partir de la réaction précédente, le rapport entre l'oxygène et le brome a été calculé, avec la valeur exacte de O: Br (0,149975: 0,3745), suggérant que le composé acide contient deux atomes d'oxygène pour un atome de brome. Ainsi, la structure chimique du composé acide a été déduite comme HBrO 2 .
Selon Richards, l'acide hypobromeux (HBrO) résulte de la réaction d'une solution de brome et de nitrate d'argent:
- Br 2 + AgNO 3 + H 2 O → HBrO + AgBr + HNO 3
- 2 AgNO 3 + HBrO + Br 2 + H 2 O → HBrO 2 + 2 AgBr + 2 HNO 3
Isomérie
La molécule HBrO 2 a une structure courbée avec des angles ∠ (H-O-Br) de 106,1 °. HOBrO adopte également une conformation non plane avec une structure isomère (2a) adoptant un angle dièdre ∠ (H-O-Br-O) de 74,2 °. De plus, les structures planes de deux autres isomères (2b- cis et 2c- trans ) sont à l'état de transition pour une énantiomérisation rapide.
Une autre étude a identifié trois isomères: HOOBr, HOBrO et HBr (O) O.
La synthèse
Une réaction d'oxydation entre l'acide hypobromeux (HBrO) et l'acide hypochloreux (HClO) peut être utilisée pour produire de l'acide bromique (HBrO 2 ) et de l'acide chlorhydrique (HCl).
- HBrO + HClO → HBrO 2 + HCl
Une réaction redox de l'acide hypobromeux (HBrO) peut former de l'acide bromeux (HBrO 2 ) comme son produit:
- HBrO + H 2 O - 2e - → HBrO 2 + 2H +
La réaction de disproportionation de deux équivalents d' acide hypobromeux (HBrO) entraîne la formation à la fois d'acide bromique (HBrO 2 ) et d'acide bromhydrique (HBr):
- 2 HBrO → HBrO 2 + HBr
Une réaction de réarrangement, qui résulte de la proportion syn de l'acide bromique (HBrO 3 ) et de l'acide bromhydrique (HBr) donne l'acide bromique (HBrO 2 ):
- 2 HBrO 3 + HBr → 3 HBrO 2
Bromite de sodium
Les sels NaBrO 2 · 3H 2 O et Ba (BrO 2 ) 2 · H 2 O ont été cristallisés. Lors du traitement de ces solutions aqueuses avec des sels de Pb 2+ , Hg 2+ et Ag + , les bromites de métaux lourds correspondants précipitent sous forme de solides.
Réaction Belousov-Zhabotinsky
L'acide bromeux est un produit de la réaction Belousov – Zhabotinsky résultant de la combinaison de bromate de potassium, de sulfate de cérium (IV), d'acide propanedioïque et d'acide citrique dans de l'acide sulfurique dilué. L'acide bromeux est une étape intermédiaire de la réaction entre l'ion bromate ( BrO -
3 ) et brome (Br - ):
-
Copain -
3 + 2 Br - → HBrO 2 + HBrO
D'autres réactions pertinentes dans de telles réactions oscillantes sont:
- HBrO 2 + BrO -
3 + H + → 2 BrO •
2 + H 2 O - 2 HBrO 2 → BrO -
3 + HOBr + H +
Les bromites réduisent les permanganates en manganates (VI):
- 2 MnO -
4 + BrO -
2 + OH - → 2 MnO 2−
4 + BrO -
3 + H 2 O
p K une mesure
La constante de dissociation acide de l'acide bromeux, K a =
[H + ] [ BrO -
2 ] / [HBrO 2 ] , a été déterminée à l'aide de différentes méthodes.
La valeur du p K a pour l'acide bromique a été estimée dans le cadre de recherches sur la décomposition des bromites. La recherche a mesuré le taux de décomposition du bromite en fonction des concentrations d'hydrogène et d'ion bromite. Les données expérimentales du log de la vitesse initiale ont été tracées par rapport au pH. En utilisant cette méthode, la valeur p K a estimée pour l'acide bromique était de 6,25.
En utilisant une autre méthode, le pK a pour l'acide bromique a été mesuré sur la base de la vitesse initiale de la réaction entre les bromites de sodium et l'iode de potassium dans une gamme de pH de 2,9 à 8,0, à 25 ° C et une force ionique de 0,06 M. Dépendance du premier ordre de la vitesse initiale de cette réaction de disproportionation sur [H + ] dans une gamme de pH de 4,5 à 8,0. La valeur de la constante de dissociation acide mesurée par cette méthode est K a = (3,7 ± 0,9) × 10 −4 M et p K a = 3,43 ± 0,05 .
Réactivité
En comparaison avec d'autres oxydants centrés sur l'oxygène (hypohalites, anions de peroxydes) et en ligne avec sa faible basicité, la bromite est un nucléophile plutôt faible. Les constantes de vitesse de la bromite vis-à-vis des carbocations et des oléfines à substitution accepteur sont de 1 à 3 ordres de grandeur inférieurs à celles mesurées avec l'hypobromite.
