Point de contrôle du cycle cellulaire - Cell cycle checkpoint
Les points de contrôle du cycle cellulaire sont des mécanismes de contrôle du cycle cellulaire eucaryote qui assurent sa bonne progression. Chaque point de contrôle sert de point de terminaison potentiel le long du cycle cellulaire , au cours duquel les conditions de la cellule sont évaluées, la progression à travers les différentes phases du cycle cellulaire n'ayant lieu que lorsque des conditions favorables sont réunies. Il existe de nombreux points de contrôle dans le cycle cellulaire, mais les trois principaux sont : le point de contrôle G1, également connu sous le nom de point de contrôle de départ ou de restriction ou point de contrôle majeur ; le point de contrôle G2/M ; et la transition métaphase-anaphase, également connue sous le nom de point de contrôle du fuseau . La progression à travers ces points de contrôle est largement déterminée par l'activation de kinases dépendantes des cyclines par des sous-unités protéiques régulatrices appelées cyclines , dont différentes formes sont produites à chaque étape du cycle cellulaire pour contrôler les événements spécifiques qui s'y produisent.
Fond
Tous les organismes vivants sont le produit de cycles répétés de croissance et de division cellulaires. Au cours de ce processus, connu sous le nom de cycle cellulaire , une cellule duplique son contenu puis se divise en deux. Le but du cycle cellulaire est de dupliquer avec précision l'ADN de chaque organisme, puis de diviser la cellule et son contenu de manière égale entre les deux cellules résultantes. Chez les eucaryotes , le cycle cellulaire se compose de quatre étapes principales : G 1 , au cours desquelles une cellule est métaboliquement active et croît continuellement ; phase S , au cours de laquelle la réplication de l'ADN a lieu ; G 2 , au cours de laquelle la croissance cellulaire se poursuit et la cellule synthétise diverses protéines en vue de la division ; et la phase M ( mitose ), au cours de laquelle les chromosomes dupliqués (appelés chromatides sœurs ) se séparent en deux noyaux filles et la cellule se divise en deux cellules filles, chacune avec une copie complète de l'ADN. Comparé au cycle cellulaire eucaryote, le cycle cellulaire procaryote (appelé fission binaire ) est relativement simple et rapide : le chromosome se réplique à partir de l'origine de la réplication, une nouvelle membrane est assemblée et la paroi cellulaire forme un septum qui divise la cellule en deux.
Comme le cycle cellulaire eucaryote est un processus complexe, les eucaryotes ont développé un réseau de protéines régulatrices, connu sous le nom de système de contrôle du cycle cellulaire , qui surveille et dicte la progression de la cellule à travers le cycle cellulaire. Ce système agit comme une minuterie ou une horloge, qui définit une durée fixe que la cellule doit passer dans chaque phase du cycle cellulaire, tout en répondant aux informations reçues des processus qu'elle contrôle. Les points de contrôle du cycle cellulaire jouent un rôle important dans le système de contrôle en détectant les défauts qui se produisent au cours de processus essentiels tels que la réplication de l'ADN ou la ségrégation des chromosomes , et en induisant un arrêt du cycle cellulaire en réponse jusqu'à ce que les défauts soient réparés. Le principal mécanisme d'action des points de contrôle du cycle cellulaire passe par la régulation des activités d'une famille de protéines kinases appelées kinases dépendantes des cyclines (CDK), qui se lient à différentes classes de protéines régulatrices appelées cyclines , avec des cyclines spécifiques. Les complexes CDK se forment et s'activent à différentes phases du cycle cellulaire. Ces complexes, à leur tour, activent différentes cibles en aval pour favoriser ou empêcher la progression du cycle cellulaire.
Point de contrôle G 1 (restriction)
Le point de contrôle G1, également connu sous le nom de point de restriction dans les cellules de mammifères et de point de départ dans la levure, est le point auquel la cellule s'engage à entrer dans le cycle cellulaire. Au fur et à mesure que la cellule progresse dans G1, en fonction des conditions internes et externes, elle peut soit retarder G1, entrer dans un état de repos connu sous le nom de G0 , soit dépasser le point de restriction. Les dommages à l'ADN sont la principale indication pour qu'une cellule "restreigne" et n'entre pas dans le cycle cellulaire. La décision de s'engager dans un nouveau cycle de division cellulaire se produit lorsque la cellule active la transcription dépendante de la cycline-CDK qui favorise l'entrée en phase S. Ce point de contrôle assure la suite du processus.
Au début de G1, il existe trois répresseurs transcriptionnels, appelés protéines de poche, qui se lient aux facteurs de transcription E2F . La famille de gènes E2F est un groupe de facteurs de transcription qui ciblent de nombreux gènes importants pour le contrôle du cycle cellulaire, notamment les cyclines , les CDK, les régulateurs de point de contrôle et les protéines de réparation de l'ADN. Une mauvaise régulation de la famille E2F est souvent observée dans les cas de cancer, ce qui prouve que la famille E2F est essentielle à la régulation stricte de la réplication et de la division de l'ADN. Les trois protéines de poche sont le rétinoblastome (Rb), p107 et p130, qui se lient aux facteurs de transcription E2F pour empêcher la progression au-delà du point de contrôle G1.
La famille de gènes E2F contient des protéines avec des mécanismes activateurs et des protéines avec des mécanismes répresseurs. P107 et p130 agissent comme co-répresseurs pour E2F 4 et E2F 5, qui agissent pour réprimer la transcription des facteurs favorisants G1-to-S. La troisième protéine de poche, Rb, se lie à et réprime E2F 1, E2F 2 et E2F 3, qui sont les protéines E2F avec des capacités d'activation.
La rétroaction positive joue un rôle essentiel dans la régulation du passage de la phase G1 à la phase S, impliquant notamment la phosphorylation de Rb par un complexe protéique Cycline/CDK. Rb sans phosphate, ou Rb non phosphorylé, régule la sortie et la différenciation du cycle cellulaire G0. Au début de la phase G1, les facteurs de croissance et les dommages à l'ADN signalent l'augmentation des niveaux de cycline D, qui se lie ensuite à Cdk4 et Cdk6 pour former le complexe CyclinD:Cdk4/6. Ce complexe est connu pour inactiver Rb par phosphorylation. Cependant, les détails de la phosphorylation de Rb sont assez complexes et spécifiques par rapport aux connaissances antérieures sur le point de contrôle G1. CyclinD:Cdk4/6 place un seul phosphate, ou monophosphorylates, Rb sur l'un de ses quatorze sites de phosphorylation accessibles et uniques. Chacune des quatorze isoformes monophosphorylées spécifiques a une préférence de liaison différentielle aux membres de la famille E2F, ce qui ajoute probablement à la diversité des processus cellulaires dans le corps des mammifères.
E2F 4 et E2F 5 dépendent de pl07 et pl30 pour maintenir leur localisation nucléaire. Cependant, la cycline D:Cdk 4/6 phosphoryle également p107 et p130, un processus qui libère leur liaison de E2F 4 et 5 (qui s'échappent ensuite vers le cytoplasme), et permet à E2F 1-3 de se lier à l'ADN et d'initier la transcription des protéines de la cycline E. Rb conservent leur état monophosphorylé au début de la phase G1, tandis que la cycline E s'accumule et se lie à Cdk2.
CyclinE:Cdk2 joue un rôle de phosphorylation supplémentaire important dans la transition G1-à-S. En particulier, CyclinE:Cdk2 favorise une boucle de rétroaction positive qui crée un commutateur « tout ou rien ». Dans de nombreux réseaux de contrôle génétique, la rétroaction positive garantit que les cellules ne glissent pas dans les deux sens entre les phases du cycle cellulaire. . L'hyper phosphorylation de Rb est considérée comme le point de restriction G1 tardif, après quoi la cellule ne peut plus revenir en arrière dans le cycle cellulaire. À ce stade, les protéines E2F 1-3 se lient à l'ADN et transcrivent la cycline A et la Cdc 6.
L'inhibiteur de kinase dépendante de la cycline 1B (CDKN1B), également connu sous le nom de p27, se lie à et empêche l'activation de CyclinE:Cdk2 par inhibition. Cependant, à mesure que la cycline A s'accumule et se lie à Cdk2, elles forment un complexe et inhibent p27. La kinase dépendante de la cycline en phase G1 travaille avec la kinase dépendante de la cycline en phase S ciblant p27 pour la dégradation. À son tour, cela permet une activation complète de Cyclin A:Cdk2, un complexe qui phosphoryle E2F 1-3 initiant leur dissociation des sites promoteurs d'ADN. Cela permet à E2F 6-8 de se lier à l'ADN et d'inhiber la transcription. La boucle de rétroaction négative utilisée pour inhiber avec succès l'inhibiteur, p27, est un autre processus essentiel utilisé par les cellules pour assurer un mouvement monodirectionnel et aucun retour en arrière dans le cycle cellulaire.
Lorsque des dommages à l'ADN se produisent, ou lorsque la cellule détecte des défauts qui l'obligent à retarder ou à arrêter le cycle cellulaire dans G1, l'arrêt se produit par plusieurs mécanismes. La réponse rapide implique des événements de phosphorylation qui démarrent avec la kinase ATM ( Ataxia télangiectasie mutée ) ou ATR ( Ataxie télangiectasie et Rad3 liés ), qui agissent comme des capteurs, selon le type de dommage. Ces kinases phosphorylent et activent respectivement les kinases effectrices Chk2 et Chk1, qui à leur tour phosphorylent la phosphatase Cdc25A, la marquant ainsi pour l'ubiquitination et la dégradation. Comme Cdc25A active le complexe cycline E-CDK2 mentionné précédemment en éliminant les phosphates inhibiteurs de CDK2, en l'absence de Cdc25A, la cycline E-CDK2 reste inactive et la cellule reste en G1.
Pour maintenir l'arrêt, une autre réponse est initiée, par laquelle Chk2 ou Chk1 phosphorylent p53, un suppresseur de tumeur, et cela stabilise p53 en l'empêchant de se lier à Mdm2, une ubiquitine ligase qui inhibe p53 en la ciblant pour la dégradation. Le p53 stable agit alors comme activateur transcriptionnel de plusieurs gènes cibles, dont p21, un inhibiteur du complexe promoteur G1-à-S cycline E-CDK2. De plus, un autre mécanisme par lequel p21 est activé est l'accumulation de p16 en réponse à des dommages à l'ADN. p16 perturbe les complexes cycline D-CDK4, provoquant ainsi la libération de p21 des complexes, ce qui conduit à la déphosphorylation et à l'activation de Rb, ce qui permet à Rb de se lier et d'inhiber E2F 1-3, empêchant ainsi la cellule de passer à la phase S. Récemment, certains aspects de ce modèle ont été contestés.
G 2 checkpoint
Après la réplication de l'ADN en phase S, la cellule subit une phase de croissance connue sous le nom de G2. Pendant ce temps, les protéines mitotiques nécessaires sont produites et la cellule est à nouveau soumise à des mécanismes de régulation pour assurer un statut approprié pour l'entrée dans la phase mitotique proliférative (M). De multiples points de contrôle mécanistiques sont impliqués dans cette transition de G2 à M, avec un facteur d'union commun d'activité cycline-Cdk.
Bien que des variations dans les complexes cycline-Cdk requis existent à travers les organismes, la nécessité de l'activité kinase est conservée et se concentre généralement sur un seul appariement. Dans la levure à fission, trois formes différentes de cycline mitotique existent, et six dans la levure en herbe, mais la cycline principale utilisée est la cycline B. La cycline B servira de référence pour la discussion de la transition du point de contrôle G2/M.
Semblable à la phase S, G2 subit un point de contrôle des dommages à l'ADN. La cellule est une fois de plus examinée pour les sites d'endommagement de l'ADN ou de réplication incomplète, et les kinases ATR et ATM sont recrutées pour endommager les sites. L'activation de Chk1 et Chk2 se produit également, ainsi que l'activation de p53, pour induire l'arrêt du cycle cellulaire et arrêter la progression vers la mitose. Un composant supplémentaire de la phase S, le complexe pré-réplicatif, doit être inactivé via la phosphorylation de la cycline B-Cdk1.
Au fur et à mesure que ces points de contrôle précédents sont évalués, l'accumulation de protéines G2 sert à activer l'activité cyclinB-Cdk1 via de multiples mécanismes. CyclinA-Cdk2 active Cdc25, un activateur de cyclinB-Cdk1, qui désactive ensuite l'inhibiteur de cyclinB-Cdk1, Wee1. Cela se traduit par une boucle de rétroaction positive, augmentant considérablement l'expression de la cyclineB et l'activation de Cdk1. Au fur et à mesure que la cellule progresse à travers G2 et atteint la transition G2/M, la kinase Plk1 phosphoryle Wee1, qui cible Wee1 pour la dégradation via le complexe SCF ubiquitine ligase. Une fonction supplémentaire de Plk1 est d'activer Cdc25 par phosphorylation. L'effet composé de la dégradation de Wee1 et de l'activation de Cdc25 est l'élimination nette de la phosphorylation inhibitrice de cdc2, qui active cdc2. Plk1 est activé à la transition G2/M par les Aurora A et Bora, qui s'accumulent pendant G2 et forment un complexe d'activation. Le complexe Plk1-Cdc2-cdc25 initie alors une boucle de rétroaction positive qui sert à activer davantage Cdc2, et en conjonction avec une augmentation des niveaux de cycline B pendant G2, les complexes cdc2-cycline B résultants activent alors des cibles en aval qui favorisent l'entrée en mitose. L'activité Cdk1 résultante active également l'expression de Mem1-Fkh, un gène de transition G2/M. L'augmentation rapide de l'activité cyclinB-Cdk1 est nécessaire, car l'initiation de la phase M est un événement tout ou rien engageant une hystérésis. L'hystérésis de l'activité Cdk1 via la cycline B entraîne l'entrée de la phase M en établissant un seuil minimum de concentration en cyclineB. Celui-ci existe à un niveau supérieur au minimum nécessaire à la poursuite de la phase M après l'entrée, agissant pour sauvegarder l'événement tout ou rien. Cette concentration d'entrée est encore augmentée en cas de réplication incomplète de l'ADN, ajoutant un autre mécanisme de régulation au point de transition G2/M. La présence d'hystérésis permet à l'entrée de la phase M d'être fortement régulée en fonction de l'activité de la cyclineB-Cdk1.
Les mécanismes par lesquels l'entrée mitotique est empêchée en réponse à des dommages à l'ADN sont similaires à ceux du point de contrôle G1/S. Les dommages à l'ADN déclenchent l'activation de la voie ATM/ATR susmentionnée, dans laquelle ATM/ATR phosphorylent et activent les kinases de point de contrôle Chk1/Chk2. Chk1/2 phosphorylé cdc25 qui, en plus d'être inhibée, est également séquestrée dans le cytoplasme par les protéines 14-3-3. 14-3-3 sont régulés positivement par p53, qui, comme mentionné précédemment, est activé par Chk1 et ATM/ATR. p53 transactive également p21, et p21 et 14-3-3 inhibent à leur tour les complexes cycline B-cdc2 par la phosphorylation et la séquestration cytoplasmique de cdc2. De plus, l'inactivation de cdc25 entraîne son incapacité à déphosphoryler et à activer cdc2. Enfin, un autre mécanisme de réponse aux dommages passe par la régulation négative de Plk1 par ATM/ATR, qui à son tour entraîne la stabilisation de Wee1 et Myt1, qui peuvent ensuite phosphoryler et inhiber cdc2, maintenant ainsi la cellule arrêtée dans G2 jusqu'à ce que les dommages soient fixé.
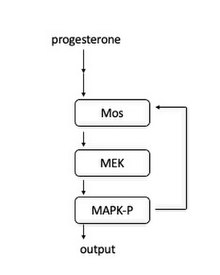
Transition G2-M dans les ovocytes de Xénope
À la fin de G2, la cellule passe en mitose, où le noyau se divise. La transition G2 à M est dramatique ; il y a un effet tout ou rien et la transition est irréversible. Ceci est avantageux pour la cellule car l'entrée en mitose est une étape critique dans le cycle de vie d'une cellule. S'il ne s'engage pas complètement, la cellule se heurterait à de nombreux problèmes de division partielle, ce qui entraînerait probablement la mort de la cellule.
Dans les ovocytes de grenouille, la cascade de signaux est induite lorsque la progestérone se lie à un récepteur lié à la membrane. En aval, Mos est activé. Mos phosphoryle alors MEK1, qui phosphoryle MAPK. MAPK remplit deux rôles : activer le complexe CyclinB-Cdk1 pour initier l'entrée dans la mitose et activer Mos. L'activation de Mos conduit à une boucle de rétroaction positive et agit donc comme un « interrupteur à bascule » pour créer l'entrée du tout ou rien dans la mitose.
Cette boucle de rétroaction a d'abord été trouvée en montrant que les concentrations de MAPK-P (MAPK phosphorylée) augmentaient en réponse à des niveaux croissants de progestérone. Au niveau d'une seule cellule, chaque cellule avait soit une MAPK entièrement phosphorylée, soit aucune MAPK phosphorylée, confirmant qu'elle agit comme un mécanisme de type commutateur dans chaque cellule. Il a en outre été montré que le blocage de la synthèse de la protéine Mos rend les réponses MAPK-P plus graduées, montrant que la synthèse de la protéine Mos est nécessaire pour le caractère tout ou rien de l'activation de MAPK.
Bistabilité
Ce processus peut être compris en utilisant la bistabilité. En utilisant le graphique montré à droite, le taux de synthèse de Mos change à mesure que plus de progestérone est ajoutée. A chaque courbe, il y a des points fixes stables et des points fixes instables. Aux points fixes instables, le système poussera vers l'un ou l'autre des points fixes stables. Ainsi, le système peut être soit à l'état « on » ou à l'état « arrêt », pas entre les deux. Lorsque le niveau de progestérone est suffisamment élevé, la courbe Mos est décalée plus haut et ne coupe finalement la ligne de dégradation qu'en un seul point, il n'y a donc qu'un seul état stable « on », indiquant l'entrée dans la mitose.
L'irréversibilité que nous voyons dans le point de transition de la mitose vient d'avoir des niveaux suffisamment élevés de progestérone dans la cellule. À des niveaux suffisamment élevés de progestérone, le système est monostable en raison de la boucle de rétroaction positive entre Mapk et Mos. Le point auquel le système passe de bistable à monostable est appelé la bifurcation du nœud de selle.
Ainsi, nous pouvons comprendre la réponse irréversible tout ou rien de la transition mitotique avec un modèle mathématique des régulateurs moléculaires comme un système bistable qui dépend de l'existence d'une rétroaction positive. L'«état off» est annihilé par un niveau suffisamment élevé de progestérone et une fois que la cellule est poussée au-delà de l'état off, elle est alors bloquée dans l'état activé.
Hystérésis et modèle de Novak Tyson
À partir de ce modèle bistable, nous pouvons comprendre la transition mitotique comme s'appuyant sur l'hystérésis pour la conduire. L'hystérésis est définie comme la dépendance de l'état d'un système à son histoire. Le modèle Novak Tyson est un modèle mathématique de la progression du cycle cellulaire qui prédit que les transitions irréversibles entrant et sortant de la mitose sont entraînées par l'hystérésis. Le modèle a trois prédictions de base qui devraient être vraies dans le cycle des extraits d'ovocytes dont la progression du cycle cellulaire dépend de l'hystérésis :
(1) La concentration de cycline B nécessaire pour entrer en mitose est supérieure à la concentration nécessaire pour maintenir un extrait mitotique en mitose.
(2) L'ADN non répliqué augmente le niveau de cycline nécessaire à l'activation de Cdc2 et donc à l'entrée en mitose.
(3) Il y a une diminution du taux d'activation de Cdc2 à des concentrations de cycline B juste au-dessus du seuil d'activation.
Sha et al ont fait des expériences sur des extraits d'œufs de Xenopus laevis en 2003 pour démontrer cette nature hystérétique. A l'aide d'extraits de cyclage, ils ont observé que le seuil d'activation de l'cycline B est compris entre 32 et 42 nM alors que le seuil d'inactivation est compris entre 16 et 24 nM de l'Δcycline B. Ces expériences ont donc confirmé la bistabilité de ce système et l'importance de l'hystérésis dans cette cellule. transition cyclable. Aux concentrations intermédiaires de cycline B, l'état interphase ou mitotique de la cellule est possible.
Réponse au stress de réplication
Étant donné que l'entrée en mitose est un engagement important et coûteux pour la cellule, il est logique que des systèmes soient en place pour empêcher une entrée prématurée dans cette étape. Il a été démontré que des erreurs dans les étapes précédentes, telles que le fait d'avoir des sections d'ADN non répliquées, bloquent la progression dans le cycle cellulaire. Le modèle de Novak Tyson prédit que cela se produit en augmentant le niveau de cycline B nécessaire à l'entrée en mitose.
Sha et al. ont étudié si cela était vrai dans les extraits d'œufs de Xenopus . Ils ont utilisé l'aphidicoline (APH) pour inhiber l'ADN polymérase et empêcher la réplication de l'ADN. Lorsqu'il est traité avec de la cycline B en interphase, le seuil d'activation a augmenté entre 80 et 100 nM, comme prédit par le modèle Novak Tyson. Ainsi, ces expériences confirment que le stress de l'ADN non répliqué dans la cellule affecte la boucle d'hystérésis et entraîne un seuil de cycline B beaucoup plus élevé pour entrer en mitose.
Point de contrôle de la métaphase
Le point de contrôle du fuseau mitotique se produit au point de la métaphase où tous les chromosomes auraient dû/s'être alignés sur la plaque mitotique et être sous tension bipolaire. La tension créée par cet attachement bipolaire est ce qui est ressenti, ce qui initie l'entrée en anaphase. Pour ce faire, le mécanisme de détection s'assure que le complexe promoteur de l' anaphase (APC/C) n'est plus inhibé, qui est désormais libre de dégrader la cycline B , qui abrite une D-box (boîte de destruction), et de décomposer la sécurine . Cette dernière est une protéine dont la fonction est d'inhiber la séparase , qui à son tour coupe les cohésines , le composite protéique responsable de la cohésion des chromatides sœurs. Une fois que cette protéine inhibitrice est dégradée par ubiquitination et protéolyse ultérieure, la séparase provoque alors la séparation des chromatides sœurs. Une fois que la cellule s'est divisée en ses deux cellules filles, la cellule entre dans G 1 .
Cancer
Les processus de réparation de l'ADN et les points de contrôle du cycle cellulaire ont été intimement liés au cancer en raison de leurs fonctions régulant respectivement la stabilité du génome et la progression cellulaire. Les mécanismes moléculaires précis qui relient les dysfonctionnements de ces voies à l'apparition de cancers particuliers ne sont pas bien compris dans la plupart des cas. Il a été démontré que la perte d'ATM précède le développement d'un lymphome, probablement en raison d'une recombinaison homologue excessive, conduisant à une instabilité génomique élevée. La perturbation de Chk1 chez la souris a entraîné une dérégulation significative des points de contrôle du cycle cellulaire, une accumulation de dommages à l'ADN et une incidence accrue de tumorigenèse. Peut-être le plus célèbre, l'héritage d'un seul mutant de BRCA1 ou BRCA2 prédispose les femmes aux cancers du sein et de l'ovaire. BRCA1 est connu pour être requis pour les transitions S et G2/M, et est impliqué dans la réponse cellulaire aux dommages de l'ADN. On pense que BRCA2 est impliqué dans la recombinaison homologue et la régulation du point de contrôle de la phase S, et les mutations des déficiences en BRCA2 sont fortement liées à la tumorigenèse.
Voir également
- Commutateurs biochimiques dans le cycle cellulaire
- Analyse du cycle cellulaire
- Point de contrôle des dommages à l'ADN G2-M
- Point de contrôle de post-réplication
- Point de contrôle de recombinaison méiotique