Phase G 0 -G0 phase
La phase G 0 décrit un état cellulaire en dehors du cycle cellulaire réplicatif . Classiquement, on pensait que les cellules entraient en G 0 principalement en raison de facteurs environnementaux, comme la privation de nutriments, qui limitaient les ressources nécessaires à la prolifération. Ainsi , il a été pensé comme une phase de repos . G 0 est maintenant connu pour prendre différentes formes et se produire pour de multiples raisons. Par exemple, la plupart des cellules neuronales adultes , parmi les cellules les plus métaboliquement actives du corps, sont complètement différenciées et résident dans une phase terminale G 0 . Les neurones résident dans cet état, non pas à cause d'un apport nutritionnel stochastique ou limité, mais dans le cadre de leur programme de développement.
G 0 a d'abord été suggéré comme un état cellulaire basé sur des études du cycle cellulaire précoce. Lorsque les premières études ont défini les quatre phases du cycle cellulaire à l'aide de techniques de marquage radioactif, il a été découvert que toutes les cellules d'une population ne prolifèrent pas à des rythmes similaires. La « fraction de croissance » d'une population – ou la fraction de la population qui augmentait – proliférait activement, mais d'autres cellules existaient dans un état non prolifératif. Certaines de ces cellules non proliférantes pourraient répondre à des stimuli extrinsèques et proliférer en rentrant dans le cycle cellulaire. Les premières vues contrastées considéraient que les cellules non proliférantes étaient simplement dans une phase G 1 étendue ou dans une phase de cycle cellulaire distincte de G 1 - appelée G 0 . Des recherches ultérieures ont mis en évidence un point de restriction ( point R) dans G 1 où les cellules peuvent entrer dans G 0 avant le point R mais sont engagées dans la mitose après le point R. Ces premières études ont fourni la preuve de l'existence d'un état G 0 auquel l'accès est restreint. Ces cellules qui ne se divisent plus sortent de la phase G1 pour entrer dans une phase inactive appelée phase de repos.
Diversité des états G 0
Trois états G 0 existent et peuvent être classés comme réversibles ( quiescents ) ou irréversibles ( sénescents et différenciés ). Chacun de ces trois états peut être entré à partir de la phase G 1 avant que la cellule ne s'engage dans le prochain tour du cycle cellulaire. La quiescence fait référence à un état G 0 réversible où des sous-populations de cellules résident dans un état « de repos » avant d'entrer dans le cycle cellulaire après activation en réponse à des signaux extrinsèques. Les cellules quiescentes sont souvent identifiées par une faible teneur en ARN , un manque de marqueurs de prolifération cellulaire et une rétention accrue des marqueurs indiquant un faible renouvellement cellulaire. La sénescence est distincte de la quiescence car la sénescence est un état irréversible dans lequel les cellules entrent en réponse à des dommages ou à une dégradation de l'ADN qui rendraient la descendance d'une cellule non viable. De tels dommages à l'ADN peuvent résulter du raccourcissement des télomères au cours de nombreuses divisions cellulaires ainsi que de l'exposition aux espèces réactives de l'oxygène (ROS), de l'activation des oncogènes et de la fusion cellule-cellule. Bien que les cellules sénescentes ne puissent plus se répliquer, elles restent capables d'effectuer de nombreuses fonctions cellulaires normales. La sénescence est souvent une alternative biochimique à l'autodestruction d'une telle cellule endommagée par apoptose . Contrairement à la sénescence cellulaire, la quiescence n'est pas un événement réactif mais fait partie de la programmation de base de plusieurs types cellulaires différents. Enfin, les cellules différenciées sont des cellules souches qui ont progressé à travers un programme de différenciation pour atteindre un état mature – différencié en phase terminale. Les cellules différenciées continuent à rester dans G 0 et remplissent leurs fonctions principales indéfiniment.
Caractéristiques des cellules souches quiescentes
Transcriptomes
Les transcriptomes de plusieurs types de cellules souches au repos, telles que les cellules hématopoïétiques , musculaires et pileuses, ont été caractérisés par des techniques à haut débit , telles que le microarray et le séquençage d'ARN . Bien qu'il existe des variations dans leurs transcriptomes individuels, la plupart des cellules souches tissulaires quiescentes partagent un schéma commun d'expression génique qui implique une régulation négative des gènes de progression du cycle cellulaire, tels que la cycline A2 , la cycline B1 , la cycline E2 et la survivine , et une régulation positive des gènes impliqués dans le régulation de la transcription et du destin des cellules souches, telles que FOXO3 et EZH1 . La régulation négative du cytochrome C mitochondrial reflète également le faible état métabolique des cellules souches quiescentes.
Épigénétique
De nombreuses cellules souches quiescentes, en particulier les cellules souches adultes , partagent également des modèles épigénétiques similaires . Par exemple, H3K4me3 et H3K27me3 sont deux modèles majeurs de méthylation des histones qui forment un domaine bivalent et sont situés à proximité des sites d'initiation de la transcription. Ces marqueurs épigénétiques se sont avérés réguler les décisions de lignée dans les cellules souches embryonnaires ainsi que contrôler la quiescence dans les cellules souches du follicule pileux et musculaire via la modification de la chromatine .
Régulation de quiescence
Régulateurs du cycle cellulaire
Des gènes suppresseurs de tumeur fonctionnels , en particulier le gène p53 et Rb , sont nécessaires pour maintenir la quiescence des cellules souches et empêcher l'épuisement du pool de cellules progénitrices par des divisions excessives. Par exemple, il a été démontré que la suppression des trois composants de la famille de protéines Rb arrête la quiescence dans les cellules souches hématopoïétiques. Il a été démontré que le manque de p53 empêche la différenciation de ces cellules souches en raison de l'incapacité des cellules à sortir du cycle cellulaire dans la phase G 0 . En plus de p53 et Rb, les inhibiteurs de kinases dépendantes de la cycline (CKI), tels que p21 , p27 et p57 , sont également importants pour maintenir la quiescence. Dans les cellules souches hématopoïétiques de souris, le knock-out de p57 et p27 conduit à la sortie de G 0 par importation nucléaire de cycline D1 et phosphorylation subséquente de Rb. Enfin, il a été démontré que la voie de signalisation Notch joue un rôle important dans le maintien de la quiescence.
Régulation post-transcriptionnelle
Il a été démontré que la régulation post-transcriptionnelle de l'expression génique via la synthèse de miARN joue un rôle tout aussi important dans le maintien de la quiescence des cellules souches. Les brins de miARN se lient à la région 3' non traduite ( 3' UTR ) des ARNm cibles , empêchant leur traduction en protéines fonctionnelles. La longueur de l'UTR 3' d'un gène détermine sa capacité à se lier aux brins de miARN, permettant ainsi la régulation de la quiescence. Quelques exemples de miARN dans les cellules souches incluent miR-126, qui contrôle la voie PI3K/AKT/mTOR dans les cellules souches hématopoïétiques, miR-489, qui supprime l' oncogène DEK dans les cellules souches musculaires, et miR-31, qui régule Myf5 dans le muscle cellules souches. La séquestration des miARN de l'ARNm au sein des complexes ribonucléoprotéiques permet aux cellules quiescentes de stocker l'ARNm nécessaire à une entrée rapide dans la phase G1 .
Réponse au stress
Les cellules souches qui sont au repos depuis longtemps sont souvent confrontées à divers facteurs de stress environnementaux, tels que le stress oxydatif . Cependant, plusieurs mécanismes permettent à ces cellules de répondre à de tels facteurs de stress. Par exemple, les facteurs de transcription FOXO répondent à la présence d' espèces réactives de l'oxygène (ROS) tandis que HIF1A et LKB1 répondent à des conditions hypoxiques . Dans les cellules souches hématopoïétiques, l' autophagie est induite pour répondre au stress métabolique.
Exemples de phase G 0 réversible
Cellules souches tissulaires
Les cellules souches sont des cellules ayant la capacité unique de produire des cellules filles différenciées et de préserver leur identité de cellules souches par auto-renouvellement. Chez les mammifères, la plupart des tissus adultes contiennent des cellules souches spécifiques aux tissus qui résident dans le tissu et prolifèrent pour maintenir l'homéostasie pendant toute la durée de vie de l'organisme. Ces cellules peuvent subir une immense prolifération en réponse à des lésions tissulaires avant de se différencier et de s'engager dans la régénération. Certaines cellules souches tissulaires existent dans un état de repos réversible indéfiniment jusqu'à ce qu'elles soient activées par des stimuli externes. Il existe de nombreux types différents de cellules souches tissulaires, notamment les cellules souches musculaires (MuSC), les cellules souches neurales (NSC), les cellules souches intestinales (ISC) et bien d'autres.
Il a été récemment suggéré que la quiescence des cellules souches se compose de deux phases fonctionnelles distinctes, G 0 et d'une phase « d'alerte » appelée G Alerte . On pense que les cellules souches effectuent une transition active et réversible entre ces phases pour répondre aux stimuli de blessure et semblent acquérir une fonction de régénération tissulaire améliorée dans G Alert . Ainsi, la transition vers G Alert a été proposée comme une réponse adaptative qui permet aux cellules souches de répondre rapidement aux blessures ou au stress en les préparant à entrer dans le cycle cellulaire. Dans les cellules souches musculaires, l' activité mTORC1 a été identifiée pour contrôler la transition de G 0 à G Alert ainsi que la signalisation via le récepteur HGF cMet .
Hépatocytes matures
Alors qu'un état de repos réversible est peut-être le plus important pour que les cellules souches tissulaires répondent rapidement aux stimuli et maintiennent une homéostasie et une régénération appropriées, des phases G 0 réversibles peuvent être trouvées dans les cellules non souches telles que les hépatocytes matures. Les hépatocytes sont généralement au repos dans les foies normaux mais subissent une réplication limitée (moins de 2 divisions cellulaires) pendant la régénération hépatique après hépatectomie partielle. Cependant, dans certains cas, les hépatocytes peuvent connaître une immense prolifération (plus de 70 divisions cellulaires) indiquant que leur capacité de prolifération n'est pas entravée par l'existence dans un état de repos réversible.
Exemples de phase G 0 irréversible
Cellules sénescentes
Souvent associées au vieillissement et aux maladies liées à l'âge in vivo, les cellules sénescentes peuvent être trouvées dans de nombreux tissus renouvelables, notamment le stroma , le système vasculaire , le système hématopoïétique et de nombreux organes épithéliaux . Résultant de l'accumulation sur de nombreuses divisions cellulaires, la sénescence est souvent observée dans les phénotypes dégénératifs associés à l'âge. Les fibroblastes sénescents dans des modèles de fonction des cellules épithéliales du sein se sont avérés perturber la production de protéines du lait en raison de la sécrétion de métalloprotéinases matricielles . De même, les cellules musculaires lisses des artères pulmonaires sénescentes provoquaient la prolifération et la migration des cellules musculaires lisses voisines, contribuant peut-être à l'hypertrophie des artères pulmonaires et éventuellement à l'hypertension pulmonaire.
Muscle différencié
Au cours de la myogenèse squelettique , les cellules progénitrices cyclables connues sous le nom de myoblastes se différencient et fusionnent en cellules musculaires non cyclables appelées myocytes qui restent dans une phase terminale G 0 . En conséquence, les fibres qui composent le muscle squelettique (myofibres) sont des cellules à noyaux multiples, appelées myonoyaux, puisque chaque myonoyau provient d'un seul myoblaste. Les cellules musculaires squelettiques continuent indéfiniment à fournir une force contractile par des contractions simultanées de structures cellulaires appelées sarcomères . Il est important de noter que ces cellules sont maintenues dans une phase terminale G 0 car la perturbation de la structure des fibres musculaires après la formation des myofibres empêcherait une bonne transmission de la force à travers la longueur du muscle. La croissance musculaire peut être stimulée par la croissance ou une blessure et implique le recrutement de cellules souches musculaires - également appelées cellules satellites - à partir d'un état de repos réversible. Ces cellules souches se différencient et fusionnent pour générer de nouvelles fibres musculaires à la fois en parallèle et en série pour augmenter la capacité de génération de force.
Le muscle cardiaque est également formé par la myogenèse, mais au lieu de recruter des cellules souches pour fusionner et former de nouvelles cellules, les cellules du muscle cardiaque – appelées cardiomyocytes – augmentent simplement de taille à mesure que le cœur grossit. Comme pour le muscle squelettique, si les cardiomyocytes devaient continuer à se diviser pour ajouter du tissu musculaire, les structures contractiles nécessaires à la fonction cardiaque seraient perturbées.
Os différencié
Parmi les quatre principaux types de cellules osseuses, les ostéocytes sont les plus courants et existent également en phase terminale G 0 . Les ostéocytes proviennent d'ostéoblastes qui sont piégés dans une matrice auto-sécrétée. Bien que les ostéocytes aient également une activité synthétique réduite, ils remplissent toujours des fonctions osseuses en plus de générer une structure. Les ostéocytes fonctionnent à travers divers mécanismes mécanosensoriels pour aider au renouvellement de routine sur la matrice osseuse.
Nerf différencié
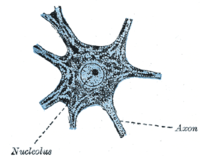
En dehors de quelques niches neurogènes dans le cerveau, la plupart des neurones sont complètement différenciés et résident dans une phase terminale G 0 . Ces neurones entièrement différenciés forment des synapses où les signaux électriques sont transmis par les axones aux dendrites des neurones voisins. Dans cet état G 0 , les neurones continuent de fonctionner jusqu'à la sénescence ou l'apoptose. De nombreuses études ont rapporté une accumulation de dommages à l'ADN avec l'âge, en particulier des dommages oxydatifs , dans le cerveau des mammifères .
Mécanisme d' entrée G 0
Rôle de Rim15
Rim15 a d'abord été découvert pour jouer un rôle essentiel dans l'initiation de la méiose dans les cellules de levure diploïdes . Dans des conditions de faible teneur en glucose et en azote, qui sont des nutriments clés pour la survie de la levure, les cellules de levure diploïdes initient la méiose par l'activation de gènes spécifiques de la méiose précoce (EMG). L'expression des EMG est régulée par Ume6. Ume6 recrute les histones désacétylases , Rpd3 et Sin3, pour réprimer l'expression EMG lorsque les niveaux de glucose et d'azote sont élevés, et il recrute le facteur de transcription EMG Ime1 lorsque les niveaux de glucose et d'azote sont faibles. Rim15, nommé pour son rôle dans la régulation d'un EMG appelé IME2, déplace Rpd3 et Sin3, permettant ainsi à Ume6 d'amener Ime1 aux promoteurs des EMG pour l'initiation de la méiose.
En plus de jouer un rôle dans l'initiation de la méiose, Rim15 s'est également avéré être un effecteur critique pour l'entrée des cellules de levure dans G 0 en présence de stress. Les signaux de plusieurs voies de signalisation des nutriments différents convergent sur Rim15, qui active les facteurs de transcription, Gis1, Msn2 et Msn4. Gis1 se lie et active les promoteurs contenant des éléments de changement de croissance post- diauxique (PDS), tandis que Msn2 et Msn4 se lient et activent des promoteurs contenant des éléments de réponse au stress (STRE). Bien qu'il ne soit pas clair comment Rim15 active Gis1 et Msn2/4, il existe certaines spéculations selon lesquelles il pourrait les phosphoryler directement ou être impliqué dans le remodelage de la chromatine. Rim15 s'est également avéré contenir un domaine PAS à son terminal N , ce qui en fait un membre nouvellement découvert de la famille des kinases PAS . Le domaine PAS est une unité régulatrice de la protéine Rim15 qui pourrait jouer un rôle dans la détection du stress oxydatif chez la levure.
Voies de signalisation des nutriments
Glucose
La levure croît de façon exponentielle par fermentation du glucose. Lorsque les niveaux de glucose baissent, la levure passe de la fermentation à la respiration cellulaire , métabolisant les produits de fermentation à partir de leur phase de croissance exponentielle. Ce décalage est connu sous le nom de décalage diauxique après lequel la levure entre en G 0 . Lorsque les niveaux de glucose dans l'environnement sont élevés, la production d' AMPc par la voie RAS-cAMP-PKA (une voie dépendante de l'AMPc ) est élevée, ce qui fait que la protéine kinase A (PKA) inhibe sa cible en aval Rim15 et permet la prolifération cellulaire. Lorsque les niveaux de glucose chutent, la production d'AMPc diminue, ce qui lève l'inhibition de Rim15 par la PKA et permet à la cellule de levure d'entrer en G 0 .
Azote
En plus du glucose, la présence d'azote est cruciale pour la prolifération des levures. Dans des conditions de faible teneur en azote, Rim15 est activé pour favoriser l'arrêt du cycle cellulaire par l'inactivation des protéines kinases TORC1 et Sch9. Alors que TORC1 et Sch9 appartiennent à deux voies distinctes, à savoir respectivement les voies induites par TOR et Fermentable Growth Medium, les deux protéines kinases agissent pour favoriser la rétention cytoplasmique de Rim15. Dans des conditions normales, Rim15 est ancré à la protéine cytoplasmique 14-3-3 , Bmh2, via la phosphorylation de son Thr1075. TORC1 inactive certaines phosphatases dans le cytoplasme, gardant Rim15 ancré à Bmh2, alors que l'on pense que Sch9 favorise la rétention cytoplasmique de Rim15 par phosphorylation d'un autre site de liaison 14-3-3 proche de Thr1075. Lorsque l'azote extracellulaire est faible, TORC1 et Sch9 sont inactivés, permettant la déphosphorylation de Rim15 et son transport ultérieur vers le noyau, où il peut activer les facteurs de transcription impliqués dans la promotion de l'entrée des cellules dans G 0 . Il a également été découvert que Rim15 favorise sa propre exportation à partir du noyau par autophosphorylation .
Phosphate
Les cellules de levure répondent à de faibles niveaux de phosphate extracellulaire en activant des gènes impliqués dans la production et la régulation à la hausse du phosphate inorganique. La voie PHO est impliquée dans la régulation des niveaux de phosphate. Dans des conditions normales, le complexe kinase cycline-dépendante de levure , Pho80-Pho85, inactive le facteur de transcription Pho4 par phosphorylation. Cependant, lorsque les niveaux de phosphate baissent, Pho81 inhibe Pho80-Pho85, permettant à Pho4 d'être actif. Lorsque le phosphate est abondant, Pho80-Pho85 inhibe également le pool nucléaire de Rim 15 en favorisant la phosphorylation de son site de liaison Thr1075 Bmh2. Ainsi, Pho80-Pho85 agit de concert avec Sch9 et TORC1 pour favoriser la rétention cytoplasmique de Rim15 dans des conditions normales.
Mécanisme de sortie G 0
Cycline C/Cdk3 et Rb
Le passage de la phase G 1 à la phase S est favorisé par l'inactivation de Rb par son hyperphosphorylation progressive par les complexes Cycline D/Cdk4 et Cycline E /Cdk2 à la fin de G 1 . Une observation précoce selon laquelle la perte de Rb favorisait la réentrée du cycle cellulaire dans les cellules G 0 a suggéré que Rb est également essentiel dans la régulation de la transition de G 0 à G 1 dans les cellules quiescentes. D'autres observations ont révélé que les niveaux d' ARNm de cycline C sont les plus élevés lorsque les cellules humaines sortent de G 0 , suggérant que la cycline C peut être impliquée dans la phosphorylation de Rb pour favoriser la réentrée dans le cycle cellulaire des cellules arrêtées par G 0 . Les dosages d' immunoprécipitation kinase ont révélé que la cycline C a une activité Rb kinase. De plus, contrairement aux cyclines D et E, l'activité Rb kinase de la cycline C est la plus élevée pendant les phases G 1 précoce et la plus faible pendant les phases G 1 et S tardives , suggérant qu'elle pourrait être impliquée dans la transition G 0 à G 1 . L'utilisation du tri cellulaire activé par fluorescence pour identifier les cellules G 0 , qui sont caractérisées par un rapport ADN/ARN élevé par rapport aux cellules G 1 , a confirmé la suspicion que la cycline C favorise la sortie de G 0 en tant que répression de la cycline C endogène par l' ARNi chez les mammifères. cellules ont augmenté la proportion de cellules arrêtées dans G 0 . D'autres expériences impliquant une mutation de Rb sur des sites de phosphorylation spécifiques ont montré que la phosphorylation de Rb par la cycline C à S807/811 est nécessaire pour la sortie de G 0 . Cependant, il reste difficile de savoir si ce schéma de phosphorylation est suffisant pour la sortie de G0. Enfin, des tests de co-immunoprécipitation ont révélé que la kinase 3 dépendante de la cycline (cdk3) favorise la sortie de G 0 en formant un complexe avec la cycline C pour phosphoryler Rb à S807/811. Fait intéressant, S807/811 sont également des cibles de phosphorylation de la cycline D/cdk4 pendant la transition G 1 à S. Cela pourrait suggérer une compensation possible de l'activité de cdk3 par cdk4, en particulier à la lumière de l'observation que la sortie de G 0 n'est retardée, et non inhibée de façon permanente, que dans les cellules dépourvues de cdk3 mais fonctionnelles dans cdk4. Malgré le chevauchement des cibles de phosphorylation, il semble que cdk3 soit toujours nécessaire pour la transition la plus efficace de G 0 à G 1 .
Sortie Rb et G 0
Des études suggèrent que la répression par Rb de la famille E2F de facteurs de transcription régule la transition G 0 à G 1 tout comme elle le fait pour la transition G 1 à S. L'activation des complexes E2F est associée au recrutement d' histones acétyltransférases , qui activent l'expression génique nécessaire à l' entrée en G 1 , tandis que les complexes E2F4 recrutent des histones désacétylases, qui répriment l'expression génique. La phosphorylation de Rb par les complexes Cdk permet sa dissociation des facteurs de transcription E2F et l'expression ultérieure des gènes nécessaires à la sortie de G 0 . D' autres membres de la Rb famille des protéines de poche , tels que P107 et P130, ont également été trouvés être impliqué dans G 0 arrestation. Les niveaux de p130 sont élevés dans G 0 et se sont avérés s'associer aux complexes E2F-4 pour réprimer la transcription des gènes cibles E2F. Pendant ce temps, P107 a été trouvé pour sauver le phénotype d'arrêt cellulaire après la perte de Rb même si P107 est exprimée à des niveaux relativement bas dans G 0 cellules. Pris ensemble, ces résultats suggèrent que la répression par Rb des facteurs de transcription E2F favorise l'arrêt cellulaire tandis que la phosphorylation de Rb conduit à la sortie de G 0 via la dérépression des gènes cibles E2F. En plus de sa régulation de l'E2F, il a également été démontré que Rb supprime l' ARN polymérase I et l' ARN polymérase III , qui sont impliquées dans la synthèse de l' ARNr . Ainsi, la phosphorylation de Rb permet également l'activation de la synthèse d'ARNr, qui est cruciale pour la synthèse des protéines lors de l'entrée en G 1 .
