Dioxyde de chlore - Chlorine dioxide
|
|
|||

|
|||
| Noms | |||
|---|---|---|---|
|
Nom IUPAC
Dioxyde de chlore
|
|||
| Autres noms
Oxyde de chlore (IV)
|
|||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| ChEBI | |||
| ChemSpider | |||
| Carte d'information de l'ECHA |
100.030.135 |
||
| Numéro CE | |||
| numéro E | E926 (agents de glaçage, ...) | ||
| 1265 | |||
| Engrener | Chlore+dioxyde | ||
|
CID PubChem
|
|||
| Numéro RTECS | |||
| UNII | |||
| Numéro ONU | 9191 | ||
|
Tableau de bord CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriétés | |||
| Cl O 2 | |||
| Masse molaire | 67,45 g·mol -1 | ||
| Apparence | Gaz jaune à rougeâtre | ||
| Odeur | Âcre | ||
| Densité | 2,757 g MS -3 | ||
| Point de fusion | −59 °C (−74 °F; 214 K) | ||
| Point d'ébullition | 11 °C (52 °F; 284 K) | ||
| 8 g/L (à 20 °C) | |||
| Solubilité | soluble dans les solutions alcalines et d'acide sulfurique | ||
| La pression de vapeur | >1 guichet automatique | ||
|
Constante de la loi de Henry ( k H ) |
4,01 × 10 −2 atm m 3 mol −1 | ||
| Acidité (p K a ) | 3.0(5) | ||
| Thermochimie | |||
|
Entropie molaire standard ( S |
257.22 JK -1 mol -1 | ||
|
Std enthalpie de
formation (Δ f H ⦵ 298 ) |
104,60 kJ/mol | ||
| Dangers | |||
| Principaux dangers | Toxicité aiguë | ||
| Fiche de données de sécurité | Archives des fiches de données de sécurité . | ||
| Pictogrammes SGH |
  
|
||
| Mention d'avertissement SGH | Danger | ||
| H271 , H314 , H330 | |||
| P210 , P220 , P280 , P283 , P260 , P264 , P271 , P284 , P301 , P330 , P331 , P311 , P306 , P360 , P304 , P340 , P305 , P351 , P338 , P371 + 380 + 375 , P405 , P403 + 233 , P501 | |||
| NFPA 704 (diamant de feu) | |||
| Dose ou concentration létale (LD, LC) : | |||
|
DL 50 ( dose médiane )
|
94 mg/kg (orale, rat) | ||
|
LC Lo (le plus bas publié )
|
260 ppm (rat, 2 heures) | ||
| NIOSH (limites d'exposition pour la santé aux États-Unis) : | |||
|
PEL (Autorisé)
|
TWA 0,1 ppm (0,3 mg/m 3 ) | ||
|
REL (recommandé)
|
TWA 0,1 ppm (0,3 mg/m 3 ) ST 0,3 ppm (0,9 mg/m 3 ) | ||
|
IDLH (Danger immédiat)
|
5 ppm | ||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Références de l'infobox | |||
Le dioxyde de chlore est un composé chimique de formule ClO 2 qui existe sous forme de gaz vert jaunâtre au- dessus de 11 °C, de liquide brun rougeâtre entre 11 °C et -59 °C et de cristaux orange vif en dessous de -59 °C. C'est un agent oxydant , capable de transférer de l'oxygène à une variété de substrats, tout en gagnant un ou plusieurs électrons via l'oxydo-réduction ( redox ). Il ne s'hydrolyse pas lorsqu'il pénètre dans l'eau et est généralement manipulé sous forme de gaz dissous en solution dans l'eau. Les dangers potentiels du dioxyde de chlore comprennent les problèmes de santé, l'explosivité et l'allumage du feu. Il est couramment utilisé comme agent de blanchiment .
Le dioxyde de chlore a été découvert en 1811 par Sir Humphry Davy et a été largement utilisé à des fins de blanchiment dans l'industrie du papier et pour le traitement de l'eau potable. Des développements plus récents ont étendu son application à la transformation des aliments, à la désinfection des locaux et des véhicules, à l'éradication des moisissures, à la désinfection de l'air et au contrôle des odeurs, au traitement des piscines, aux applications dentaires et au nettoyage des plaies.
Le composé a été frauduleusement commercialisé comme un remède ingérable pour un large éventail de maladies, y compris l'autisme infantile et le COVID-19 . Les enfants qui ont reçu des lavements de dioxyde de chlore comme un remède supposé pour l'autisme infantile ont souffert de maladies mortelles. La Food and Drug Administration (FDA) des États-Unis a déclaré que l'ingestion ou toute autre utilisation interne de dioxyde de chlore (autre que peut-être le rinçage oral sous la supervision d'un dentiste) n'a aucun effet bénéfique sur la santé et qu'il ne doit pas être utilisé en interne pour quelque raison que ce soit.
Structure et collage
Le dioxyde de chlore est un composé chloré neutre . Il est très différent du chlore élémentaire, tant par sa structure chimique que par son comportement. L'une des qualités les plus importantes du dioxyde de chlore est sa grande solubilité dans l'eau, en particulier dans l'eau froide. Le dioxyde de chlore ne s'hydrolyse pas lorsqu'il pénètre dans l'eau; il reste un gaz dissous en solution. Le dioxyde de chlore est environ 10 fois plus soluble dans l'eau que le chlore, mais sa solubilité est très dépendante de la température.
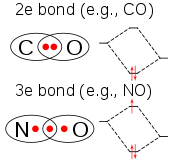
La molécule ClO 2 a un nombre impair d' électrons de valence , et par conséquent, c'est un radical paramagnétique . En 1933, Lawrence O. Brockway , un étudiant diplômé de Linus Pauling , proposa une structure impliquant une liaison à trois électrons et deux liaisons simples. Cependant, Pauling dans sa chimie générale montre une double liaison à un oxygène et une simple liaison plus une liaison à trois électrons à l'autre. En fait, il y a une résonance - en plus des liaisons simples à chaque oxygène, il existe une liaison à trois électrons qui est en résonance entre aller à l'un et aller à l'autre. La liaison à trois électrons représente une liaison plus faible que la double liaison. Dans la théorie des orbitales moléculaires, cette idée est courante si le troisième électron est placé dans une orbitale anti-liaison. Des travaux ultérieurs ont confirmé que la plus haute orbitale moléculaire occupée est en effet une orbitale anti-liante incomplètement remplie.
Propriétés
Le dioxyde de chlore est un gaz jaune rougeâtre à température et pression standard . Il est très explosif, se décomposant en chlore et en oxygène. Pour cette raison, il est dangereux d'ajouter de l'acide sulfurique ou tout acide fort à un chlorate solide en raison de la production de dioxyde de chlore.
Une solution de dioxyde de chlore dans l'eau est jaune à brun jaunâtre.
Préparation
Le dioxyde de chlore est un composé qui peut se décomposer extrêmement violemment lorsqu'il est séparé des substances diluantes. En conséquence, les méthodes de préparation qui impliquent de produire des solutions de celui-ci sans passer par une étape en phase gazeuse sont souvent préférées. Il est essentiel d'organiser la manipulation de manière sûre.
Oxydation du chlorite
En laboratoire, le ClO 2 peut être préparé par oxydation du chlorite de sodium par le chlore :
- 2 NaClO 2 + Cl 2 → 2 ClO 2 + 2 NaCl
Traditionnellement, le dioxyde de chlore pour les applications de désinfection était fabriqué à partir de chlorite de sodium ou de la méthode chlorite- hypochlorite de sodium :
- 2 NaClO 2 + 2 HCl + NaOCl → 2 ClO 2 + 3 NaCl + H 2 O
ou la méthode chlorite de sodium- acide chlorhydrique :
- 5 NaClO 2 + 4 HCl → 5 NaCl + 4 ClO 2 + 2 H 2 O
ou la méthode chlorite- acide sulfurique :
- 4 ClO−
2+ 2 H 2 SO 4 → 2 ClO 2 + HClO 3 + 2 SO2−
4+ H 2 O + HCl
Les trois méthodes peuvent produire du dioxyde de chlore avec un rendement de conversion élevé en chlorite. Contrairement aux autres procédés, la méthode chlorite-acide sulfurique produit du dioxyde de chlore totalement exempt de chlore, bien qu'elle nécessite 25 % de chlorite en plus pour produire une quantité équivalente de dioxyde de chlore. En variante, le peroxyde d'hydrogène peut être utilisé efficacement dans des applications à petite échelle.
Réduction du chlorate
En laboratoire, le dioxyde de chlore peut également être préparé par réaction du chlorate de potassium avec l'acide oxalique :
- 2 KClO 3 + 2 H 2 C 2 O 4 → K 2 C 2 O 4 + 2 ClO 2 + 2 CO 2 + 2 H 2 O
ou avec de l'acide oxalique et sulfurique :
- 2 KClO 3 + H 2 C 2 O 4 + 2 H 2 SO 4 → 2 KHSO 4 + 2 ClO 2 + 2 CO 2 + 2 H 2 O
Plus de 95 % du dioxyde de chlore produit dans le monde aujourd'hui est fabriqué par réduction du chlorate de sodium , destiné à être utilisé dans le blanchiment de la pâte . Il est produit avec une grande efficacité dans une solution acide forte avec un agent réducteur approprié tel que le méthanol , le peroxyde d'hydrogène , l'acide chlorhydrique ou le dioxyde de soufre . Les technologies modernes sont basées sur le méthanol ou le peroxyde d'hydrogène, car ces chimies permettent la meilleure économie et ne coproduisent pas de chlore élémentaire. La réaction globale peut s'écrire :
- chlorate + acide + agent réducteur → dioxyde de chlore + sous-produits
À titre d'exemple typique, on pense que la réaction du chlorate de sodium avec l'acide chlorhydrique dans un seul réacteur se déroule selon la voie suivante :
-
ClO−
3+ Cl−
+ H+
→ ClO−
2 + HOCl -
ClO−
3+ ClO−
2+ 2H+
→ 2 ClO
2+ H
2O -
HOCl + Cl−
+ H+
→ Cl
2+ H
2O
ce qui donne la réaction globale
- 2 ClO−
3+ 2cl−
+ 4H+
→ 2 ClO
2+ Cl
2+ 2H
2O .
La voie de production commercialement plus importante utilise le méthanol comme agent réducteur et l'acide sulfurique pour l'acidité. Deux avantages de ne pas utiliser les procédés à base de chlorure sont qu'il n'y a pas de formation de chlore élémentaire et que le sulfate de sodium , un produit chimique précieux pour l'usine de pâte à papier, est un produit secondaire. Ces procédés à base de méthanol offrent un rendement élevé et peuvent être rendus très sûrs.
La variante de procédé utilisant du chlorate, du peroxyde d'hydrogène et de l'acide sulfurique est de plus en plus utilisée depuis 1999 pour le traitement de l'eau et d'autres applications de désinfection à petite échelle , car elle produit un produit sans chlore à haute efficacité.
Autres processus
Le dioxyde de chlore très pur peut également être produit par électrolyse d'une solution de chlorite :
- 2 NaClO 2 + 2 H 2 O → 2 ClO 2 + 2 NaOH + H 2
Le dioxyde de chlore gazeux de haute pureté (7,7 % dans l'air ou l'azote) peut être produit par la méthode gaz-solide, qui fait réagir du chlore gazeux dilué avec du chlorite de sodium solide :
- 2 NaClO 2 + Cl 2 → 2 ClO 2 + 2 NaCl
Propriétés de manipulation
À des pressions partielles supérieures à 10 kPa (1,5 psi) (ou à des concentrations en phase gazeuse supérieures à 10 % en volume dans l'air à la STP ), le ClO 2 peut se décomposer de manière explosive en chlore et en oxygène . La décomposition peut être initiée par la lumière, des points chauds, une réaction chimique ou un choc de pression. Ainsi, le dioxyde de chlore gazeux n'est jamais manipulé sous forme concentrée, mais est presque toujours manipulé sous forme de gaz dissous dans l'eau dans une plage de concentration de 0,5 à 10 grammes par litre. Sa solubilité augmente à des températures plus basses, il est donc courant d'utiliser de l'eau réfrigérée (5 °C, 41 °F) lors du stockage à des concentrations supérieures à 3 grammes par litre. Dans de nombreux pays, tels que les États-Unis, le dioxyde de chlore gazeux ne peut être transporté à aucune concentration et est presque toujours produit sur le site d'application à l'aide d'un générateur de dioxyde de chlore. Dans certains pays, les solutions de dioxyde de chlore dont la concentration est inférieure à 3 grammes par litre peuvent être transportées par voie terrestre, cependant, elles sont relativement instables et se détériorent rapidement.
Les usages
Le dioxyde de chlore est utilisé pour le blanchiment de la pâte de bois et pour la désinfection (appelée chloration ) de l'eau potable municipale, le traitement de l'eau dans les applications pétrolières et gazières, la désinfection dans l'industrie alimentaire, le contrôle microbiologique dans les tours de refroidissement et le blanchiment des textiles. En tant que désinfectant, il est efficace même à de faibles concentrations en raison de ses qualités uniques.
Blanchiment
Le dioxyde de chlore est parfois utilisé pour le blanchiment de la pâte de bois en combinaison avec du chlore, mais il est utilisé seul dans les séquences de blanchiment ECF (sans chlore élémentaire). Il est utilisé à pH modérément acide (3,5 à 6). L'utilisation de dioxyde de chlore minimise la quantité de composés organochlorés produits. Le dioxyde de chlore (technologie ECF) est actuellement la méthode de blanchiment la plus importante au monde. Environ 95 % de toutes les pâtes kraft blanchies sont fabriquées à l'aide de dioxyde de chlore dans les séquences de blanchiment ECF.
Le dioxyde de chlore a été utilisé pour blanchir la farine .
Traitement de l'eau
L' usine de traitement de l'eau de Niagara Falls, dans l'État de New York , a utilisé pour la première fois du dioxyde de chlore pour le traitement de l'eau potable en 1944 pour détruire « le goût et l'odeur des composés phénoliques ». Le dioxyde de chlore a été introduit à grande échelle comme désinfectant de l'eau potable en 1956, lorsque Bruxelles , en Belgique, est passé du chlore au dioxyde de chlore. Son utilisation la plus courante dans le traitement de l'eau est comme préoxydant avant la chloration de l'eau potable pour détruire les impuretés naturelles de l'eau qui produiraient autrement des trihalométhanes lors de l'exposition au chlore libre. Les trihalométhanes sont des sous-produits de désinfection cancérigènes suspectés associés à la chloration des matières organiques naturellement présentes dans l'eau brute. Le dioxyde de chlore est également supérieur au chlore lorsqu'il fonctionne au-dessus de pH 7, en présence d'ammoniac et d'amines et pour le contrôle des biofilms dans les systèmes de distribution d'eau. Le dioxyde de chlore est utilisé dans de nombreuses applications industrielles de traitement de l'eau en tant que biocide, notamment les tours de refroidissement , les eaux de traitement et la transformation des aliments.
Le dioxyde de chlore est moins corrosif que le chlore et supérieur pour le contrôle des bactéries Legionella . Le dioxyde de chlore est supérieur à d'autres méthodes de désinfection secondaire de l'eau en ce sens que le dioxyde de chlore est un biocide enregistré par l' EPA , n'est pas affecté négativement par le pH, ne perd pas son efficacité avec le temps (les bactéries ne deviendront pas résistantes), et n'est pas négativement impacté par la silice et les phosphates , qui sont des inhibiteurs de corrosion couramment utilisés dans l'eau potable.
Il est plus efficace comme désinfectant que le chlore dans la plupart des cas contre les agents pathogènes d'origine hydrique tels que les virus , les bactéries et les protozoaires , y compris les kystes de Giardia et les oocystes de Cryptosporidium .
L'utilisation de dioxyde de chlore dans le traitement de l'eau conduit à la formation du sous-produit chlorite, qui est actuellement limité à un maximum de 1 partie par million dans l'eau potable aux États-Unis. Cette norme de l'EPA limite l'utilisation de dioxyde de chlore aux États-Unis à une eau de qualité relativement élevée, car cela minimise la concentration de chlorite ou à l'eau qui doit être traitée avec des coagulants à base de fer (le fer peut réduire le chlorite en chlorure).
Utilisation dans les crises publiques
Le dioxyde de chlore a de nombreuses applications en tant qu'oxydant ou désinfectant. Le dioxyde de chlore peut être utilisé pour la désinfection de l' air et a été le principal agent utilisé dans la décontamination des bâtiments aux États - Unis après les attaques à l' anthrax de 2001 . Après la catastrophe de l' ouragan Katrina à la Nouvelle-Orléans , en Louisiane et sur la côte du Golfe environnante, le dioxyde de chlore a été utilisé pour éradiquer les moisissures dangereuses des maisons inondées par les eaux de crue.
Pour lutter contre la pandémie de COVID-19, l' Agence américaine de protection de l'environnement a publié une liste de nombreux désinfectants qui répondent à ses critères d'utilisation dans les mesures environnementales contre le coronavirus responsable . Certains sont à base de chlorite de sodium activé en dioxyde de chlore, bien que des formulations différentes soient utilisées dans chaque produit. De nombreux autres produits de la liste EPA contiennent de l'hypochlorite de sodium , dont le nom est similaire mais ne doit pas être confondu avec le chlorite de sodium car ils ont des modes d'action chimique très différents.
Autres utilisations de désinfection
Le dioxyde de chlore peut être utilisé comme traitement fumigant pour « désinfecter » les fruits tels que les bleuets, les framboises et les fraises qui développent des moisissures et des levures.
Le dioxyde de chlore peut être utilisé pour désinfecter la volaille par pulvérisation ou immersion après l'abattage.
Le dioxyde de chlore peut être utilisé pour la désinfection des endoscopes , comme sous le nom commercial Tristel. Il est également disponible dans un trio composé d'un pré-nettoyage précédent avec un tensioactif et d'un rinçage suivant avec de l'eau déminéralisée et un antioxydant à faible niveau.
Le dioxyde de chlore peut être utilisé pour lutter contre les moules zébrées et quagga dans les prises d'eau.
Le dioxyde de chlore s'est avéré efficace dans l' éradication des punaises de lit.
Pour la purification de l'eau pendant le camping , les comprimés générant du dioxyde de chlore désinfectent plus d'agents pathogènes que l'eau de Javel domestique, mais à un coût par volume plus élevé.
Pseudomédecine
Le dioxyde de chlore est frauduleusement commercialisé comme un remède magique pour une gamme de maladies allant du cancer du cerveau au VIH/SIDA . Les lavements au dioxyde de chlore sont un remède supposé pour l' autisme infantile , ce qui entraîne des plaintes auprès de la FDA signalant des réactions potentiellement mortelles, voire la mort. Le dioxyde de chlore est réétiqueté en une variété de noms de marque, y compris, mais sans s'y limiter, MMS, Miracle Mineral Solution et protocole CD. Il n'y a aucune base scientifique pour les propriétés médicales du dioxyde de chlore et la FDA a mis en garde contre son utilisation.
Autres utilisations
Le dioxyde de chlore est utilisé comme oxydant pour détruire les phénols dans les flux d' eaux usées et pour le contrôle des odeurs dans les épurateurs d'air des usines de sous-produits animaux (équarrissage). Il est également disponible pour une utilisation comme déodorant pour les voitures et les bateaux, dans des emballages générant du dioxyde de chlore qui sont activés par l'eau et laissés dans le bateau ou la voiture pendant la nuit.
Problèmes de sécurité dans l'eau et les suppléments
Le dioxyde de chlore est toxique, par conséquent, des limites d'exposition sont nécessaires pour garantir son utilisation en toute sécurité. L' Environmental Protection Agency des États-Unis a fixé un niveau maximum de 0,8 mg/L pour le dioxyde de chlore dans l'eau potable. L' Occupational Safety and Health Administration (OSHA), une agence du département du Travail des États-Unis , a fixé une limite d'exposition admissible sur 8 heures de 0,1 ppm dans l'air (0,3 mg / m 3 ) pour les personnes travaillant avec du dioxyde de chlore.
Le 30 juillet 2010, et de nouveau le 1er octobre 2010, la Food and Drug Administration des États-Unis a mis en garde contre l'utilisation du produit « Miracle Mineral Supplement », ou « MMS », qui, lorsqu'il est préparé selon les instructions, produit du dioxyde de chlore. Le MMS a été commercialisé comme traitement pour une variété de conditions, y compris le VIH, le cancer, l' autisme et l'acné. Les avertissements de la FDA informaient les consommateurs que le MMS pouvait nuire gravement à la santé et indiquaient qu'il avait reçu de nombreux rapports de nausées, de diarrhée, de vomissements sévères et d'hypotension potentiellement mortelle causée par la déshydratation. Cet avertissement a été répété une troisième fois le 12 août 2019 et une quatrième le 8 avril 2020, indiquant que l'ingestion de MMS équivaut à boire de l'eau de Javel, et exhortant les consommateurs à ne pas les utiliser ou à donner ces produits à leurs enfants pour quelque raison que ce soit. .
Les références
Liens externes
-
 Médias liés au dioxyde de chlore sur Wikimedia Commons
Médias liés au dioxyde de chlore sur Wikimedia Commons