Faire face au réarrangement - Cope rearrangement
| Faire face au réarrangement | |
|---|---|
| Nommé après | Arthur C. faire face |
| Type de réaction | Réaction de réarrangement |
| Identifiants | |
| Portail de la chimie organique | faire face-réarrangement |
| ID d'ontologie RSC | RXNO: 0000028 |
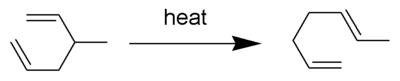
Le réarrangement Cope est une réaction organique largement étudiée impliquant le réarrangement [3,3] -sigmatropique des 1,5-diènes. Il a été développé par Arthur C. Cope et Elizabeth Hardy . Par exemple, le 3-méthyl-hexa-1,5-diène chauffé à 300 ° C donne de l'hepta-1,5-diène.
Le réarrangement Cope provoque les états fluxionnels des molécules de la famille des bullvalènes .
Mécanisme
Le réarrangement Cope est l'exemple prototypique d'un réarrangement sigmatropique concerté. Il est classé comme un réarrangement [3,3] -sigmatrope avec le symbole Woodward – Hoffmann [ π 2 s + σ 2 s + π 2 s ] et est donc thermiquement autorisé. Il est parfois utile de penser qu'il passe par un état de transition énergétiquement et structurellement équivalent à un diradical , bien que le diradical ne soit généralement pas un véritable intermédiaire (énergie potentielle minimale). L'état de transition de chaise illustré ici est préféré dans les systèmes à chaîne ouverte (comme le montrent les expériences Doering-Roth). Cependant, les systèmes contraints par la conformation comme les cis -1,2-divinylcyclopropanes peuvent subir le réarrangement dans la conformation du bateau.
Il est actuellement généralement admis que la plupart des réarrangements Cope suivent une route concertée autorisée à travers un état de transition aromatique de Hückel et qu'un intermédiaire diradical n'est pas formé. Cependant, la réaction concertée peut souvent être asynchrone et les systèmes électroniquement perturbés peuvent avoir un caractère diradical considérable à l'état de transition. Une illustration représentative de l'état de transition du réarrangement Cope de l' hexa-1,5-diène électroniquement neutre est présentée ci-dessous. Ici, on peut voir que les deux liaisons π se cassent alors que deux nouvelles liaisons π se forment, et simultanément la liaison σ se rompt tandis qu'une nouvelle liaison σ se forme. Contrairement au réarrangement de Claisen, les réarrangements Cope sans libération de contrainte ni perturbation électronique sont souvent proches de la neutralité thermique, et peuvent donc n'atteindre qu'une conversion partielle en raison d'une constante d'équilibre insuffisamment favorable. Dans le cas de l'hexa-1,5-diène, le réarrangement est dégénéré (le produit est identique au matériau de départ), donc K = 1 par nécessité.
Dans les diènes asymétriques, il faut souvent considérer la stéréochimie, qui dans le cas de réactions péricycliques, comme le réarrangement Cope, peut être prédite avec les règles de Woodward – Hoffmann et la considération de la préférence pour la géométrie de l'état de transition de la chaise.
Exemples
Le réarrangement est largement utilisé en synthèse organique. Elle est symétrique - admise lorsqu'elle est suprafaciale sur tous les composants. L'état de transition de la molécule passe à travers un bateau ou une chaise comme un état de transition. Un exemple du réarrangement de Cope est l'expansion d'un cycle cyclobutane en un cycle cycloocta-1,5-diène :
Dans ce cas, la réaction doit passer par l' état de transition bateau pour produire les deux doubles liaisons cis . Une double liaison trans dans l'anneau serait trop tendue . La réaction se produit dans des conditions thermiques. La force motrice de la réaction est la perte de déformation du cycle cyclobutane.
Réarrangement d'Oxy-Cope et sa variante anionique
Dans le réarrangement oxy-Cope, un groupe hydroxyle est ajouté en C3 formant un énal ou énone après la tautomérie céto-énol de l'énol intermédiaire.
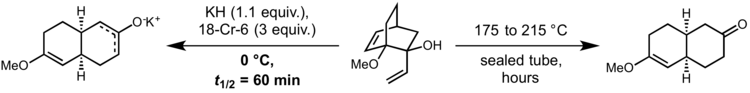
Dans sa forme originale, la réaction a besoin de températures très élevées pour se dérouler à une vitesse raisonnable. Cependant, en 1975, David A. Evans et AM Golob ont montré que la déprotonation de substrats oxy-Cope à base forte pour former l'alcoolate de potassium correspondant entraînait des accélérations de vitesse de 10 10 à 10 17 par rapport à la réaction conduite dans des conditions neutres. Cela permet à la réaction d'être conduite à température ambiante ou même à 0 ° C. Généralement, l'hydrure de potassium et la 18-couronne-6 sont utilisés pour générer un alcoolate de potassium totalement dissocié:
Le diastéréoisomère du matériau de départ présenté ci-dessus avec un groupe vinyle équatorial ne réagit pas, ce qui prouve le caractère concerté de cette réaction. Néanmoins, on pense que l'état de transition de la réaction a un degré élevé de caractère diradical. Par conséquent, la réaction oxy-Cope accélérée par un anion peut se dérouler avec une efficacité élevée même dans des systèmes qui ne permettent pas un chevauchement orbital efficace , comme le montre cet exemple de la synthèse de périplanone B par Stuart Schreiber et S.Santini :
Les auteurs remarquent que les réarrangements oxy-Cope et siloxy-Cope neutres correspondants ont échoué, ne donnant que des produits d'élimination à 200 ° C.
Variations
Une autre variante du réarrangement Cope est les réactions d'hétéroatome Cope telles que les réarrangements aza-Cope . Un autre réarrangement sigmatropique [3,3] largement étudié est le réarrangement de Claisen . Voir également le réarrangement divinylcyclopropane-cycloheptadiène .