Chlorure de diéthylaluminium - Diethylaluminium chloride
|
|
| Noms | |
|---|---|
|
Nom IUPAC
Chlorodiéthylalumane
|
|
| Autres noms
Chlorodiéthylaluminium
|
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| 4123259 | |
| ChemSpider | |
| Carte d'information de l'ECHA |
100.002.253 |
| Numéro CE | |
|
CID PubChem
|
|
| Numéro RTECS | |
| UNII | |
| Numéro ONU | 3394 |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 4 H 10 Al Cl | |
| Masse molaire | 120,56 g·mol -1 |
| Apparence | Liquide incolore |
| Densité | 0,96 g / cm 3 |
| Point de fusion | −74 °C (−101 °F; 199 K) |
| Point d'ébullition | 125 à 126 °C (257 à 259 °F ; 398 à 399 K) à 50 mmHg |
| Réagit | |
| La pression de vapeur | 3 mmHg (à 60 °C) |
| Dangers | |
|
Classification UE (DSD) (obsolète)
|
|
| Phrases R (obsolètes) | R14/15 , R17 , R34 |
| Phrases S (obsolètes) | S26 , S36/37/39 , S43 , S45 |
| NFPA 704 (diamant de feu) | |
| point de rupture | −18 °C (0 °F; 255 K) |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
| Références de l'infobox | |
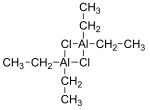
Le chlorure de diéthylaluminium , en abrégé DEAC, est un composé organoaluminique . Bien que généralement donné la formule chimique (C 2 H 5 ) 2 AlCl, il existe sous forme de dimère, [(C 2 H 5 ) 2 AlCl] 2 C'est un précurseur des catalyseurs de Ziegler-Natta employés pour la production de polyoléfines . Le composé est également un acide de Lewis , utile en synthèse organique . Le composé est un solide cireux incolore, mais est généralement manipulé sous forme de solution dans des solvants hydrocarbonés. Il est très réactif, voire pyrophorique.
Structure
Les composés de formule empirique AlR 2 Cl (R = alkyle , aryle ) existent sous forme de dimères de formule (R 2 Al) 2 (μ-Cl) 2 . L'aluminium adopte une géométrie tétraédrique.
Production
Le chlorure de diéthylaluminium peut être produit à partir de sesquichlorure d'éthylaluminium , (C 2 H 5 ) 3 Al 2 Cl 3 , par réduction avec du sodium :
- 2 (C 2 H 5 ) 3 Al 2 Cl 3 + 3 Na → 3 (C 2 H 5 ) 2 AlCl + Al + 3 NaCl
Il est également obtenu à partir de la réaction du triéthylaluminium avec l'acide chlorhydrique :
- (C 2 H 5 ) 3 Al + HCl → (C 2 H 5 ) 2 AlCl + C 2 H 6
Des réactions de reproportionnement peuvent également être utilisées :
- 2 (C 2 H 5 ) 3 Al + AlCl 3 → 3 (C 2 H 5 ) 2 AlCl
- (C 2 H 5 ) 3 Al 2 Cl 3 + (C 2 H 5 ) 3 Al → 3 (C 2 H 5 ) 2 AlCl
Les usages
Le chlorure de diéthylaluminium et d'autres composés organoaluminiques sont utilisés en combinaison avec des composés de métaux de transition comme catalyseurs de Ziegler-Natta pour la polymérisation de divers alcènes.
En tant qu'acide de Lewis, le chlorure de diéthylaluminium a également des utilisations en synthèse organique. Par exemple, il est utilisé pour catalyser les réactions Diels-Alder et ène . Alternativement, il peut réagir comme un nucléophile ou un capteur de protons.
Sécurité
Le chlorure de diéthylaluminium est non seulement inflammable mais pyrophorique.
Les références
- Hu, YJ; Jiang, HL ; Wang, HH, "Préparation de polyéthylène hautement ramifié avec catalyseur acénaphtènediimine chlorure de nickel/chlorure de diéthylaluminium". Journal chinois de la science des polymères 2006, 24 (5), 483-488.
- Yao, YM; Qi, GZ ; Shen, Q.; Hu, JY ; Lin, YH, "Réactivité et caractérisation structurelle de l'aryloxyde de samarium divalent avec le chlorure de diéthylaluminium". Bulletin scientifique chinois 2003, 48 (20), 2164-2167.
Liens externes
-
 Médias liés au chlorure de diéthylaluminium sur Wikimedia Commons
Médias liés au chlorure de diéthylaluminium sur Wikimedia Commons

