Tissu lymphoïde associé à l'intestin - Gut-associated lymphoid tissue
| Tissu lymphoïde associé à l'intestin | |
|---|---|
| Des détails | |
| Système | Système lymphatique |
| Identifiants | |
| Acronyme (s) | GALT |
| Terminologie anatomique | |
Le tissu lymphoïde associé à l'intestin (GALT) est un composant du tissu lymphoïde associé à la muqueuse (MALT) qui agit dans le système immunitaire pour protéger le corps d'une invasion dans l' intestin .
En raison de sa fonction physiologique dans l'absorption des aliments, la surface muqueuse est mince et agit comme une barrière perméable à l'intérieur du corps. De même, sa fragilité et sa perméabilité créent une vulnérabilité à l'infection et, en fait, la grande majorité des agents infectieux envahissant le corps humain utilisent cette voie. L'importance fonctionnelle de GALT dans la défense de l'organisme repose sur sa grande population de plasmocytes , qui sont des producteurs d' anticorps , dont le nombre dépasse le nombre de plasmocytes dans la rate , les ganglions lymphatiques et la moelle osseuse combinés. GALT représente environ 70% du système immunitaire en poids; une GALT compromise peut affecter de manière significative la force du système immunitaire dans son ensemble.
Structure
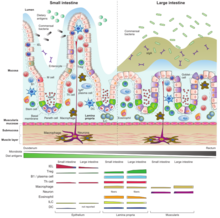
Le tissu lymphoïde associé à l'intestin s'étend dans tout l'intestin, couvrant une superficie d'environ 260 à 300 m 2 . Afin d'augmenter la surface d'absorption, la muqueuse intestinale est constituée de saillies en forme de doigt ( villosités ), recouvertes d'une monocouche de cellules épithéliales , qui sépare le GALT de la lumière de l'intestin et de son contenu. Ces cellules épithéliales sont recouvertes d'une couche de glycocalyx sur leur surface luminale afin de protéger les cellules du pH acide.
De nouvelles cellules épithéliales dérivées de cellules souches sont constamment produites au bas des glandes intestinales , régénérant l'épithélium (le temps de renouvellement des cellules épithéliales est inférieur à une semaine). Bien que dans ces cryptes, les entérocytes conventionnels soient le type dominant de cellules, des cellules Paneth peuvent également être trouvées. Celles-ci sont situées au bas des cryptes et libèrent un certain nombre de substances antibactériennes, parmi lesquelles le lysozyme, et seraient impliquées dans le contrôle des infections.
En dessous, il y a une couche sous-jacente de tissu conjonctif lâche appelé lamina propria . Il existe également une circulation lymphatique à travers le tissu connecté aux ganglions lymphatiques mésentériques .
Le GALT et les ganglions lymphatiques mésentériques sont des sites où la réponse immunitaire est déclenchée en raison de la présence de cellules immunitaires à travers les cellules épithéliales et la lamina propria .
Le GALT comprend également les plaques de Peyer de l' intestin grêle , des follicules lymphoïdes isolés présents dans tout l'intestin et l' appendice chez l'homme.
Les exemples suivants comprennent des tissus lymphoïdes qui agissent comme interfaces entre le système immunitaire et les antigènes entrants, soit comme antigènes alimentaires, soit comme antigènes pathogènes ou commensaux du microbiote:
- Anneau amygdalien de Waldeyer
- Petits agrégats lymphoïdes dans l' œsophage
- Tissu lymphoïde s'accumulant avec l'âge dans l' estomac
- Plaques de Peyer dans l'intestin grêle
- Cellules lymphoïdes et plasmocytes distribués de manière diffuse dans la lamina propria de l'intestin
- Lymphocytes intraépithéliaux ( IEL ) intercalés dans la couche épithéliale des surfaces muqueuses
- Agrégats lymphoïdes dans l' appendice et le gros intestin
- Ganglions lymphatiques mésentériques drainant la lymphe provenant du tissu intestinal
GALT peut également être divisé en deux catégories compte tenu de la structure à partir de laquelle la fonction découle. On peut y trouver 1.) GALT organisé composé de folicules - tels que les plaques de Peyer, les ganglions lymphatiques mésentériques et l'appendice encore plus organisé. Sa fonction principale est d'induire une réaction immunitaire. 2.) GALT diffus avec des cellules T et B uniques, des macrophages, des éosinophiles, des basophiles et des mastocytes, que l'on trouve préférentiellement dans la lamina propria. Cette partie de GALT est constituée de cellules effectrices matures prêtes à réaliser leurs actions.
les plaques de Peyer
Le patch de Peyer est un agrégat de cellules lymphoïdes projetées dans la lumière de l'intestin qui agit comme un site très important pour l'initiation de la réponse immunitaire. Il forme un dôme sous-épithélial dans lequel un grand nombre de follicules de cellules B avec ses centres germinaux, les cellules T se trouvent entre eux en un plus petit nombre et des cellules dendritiques. Dans cette zone, le dôme sous-épithélial est séparé de la lumière intestinale par une couche d' épithélium associé au follicule . Celui-ci contient des cellules épithéliales intestinales conventionnelles et un petit nombre de cellules épithéliales spécialisées appelées cellules microfold (cellules M) entre les deux. Contrairement aux entérocytes, ces cellules M présentent une surface luminale pliée au lieu des microvillosités, ne sécrètent pas d'enzymes digestives ou de mucus et manquent d'une surface épaisse de glycocalix, de sorte qu'elles peuvent être en contact avec le microbiote et les antigènes présentés dans le contenu de l'intestin.
Fonction
Dans des circonstances normales, le système immunitaire de tout l'organisme a besoin d'une source intestinale d'antigènes pour entraîner et réguler le développement de diverses cellules immunitaires. Sans une telle stimulation, de nombreuses propriétés du système immunitaire ne se développent pas, comme le montre le cas des animaux sans germes. Parce que les cellules immunitaires sont en contact constant avec les antigènes bactériens et alimentaires, la réponse primaire est établie comme tolérogène. Il faut encore une défense solide dans le cas où les agents pathogènes traversent la frontière de l'épithélium ou produisent des substances nocives comme des toxines bactériennes. Une telle marche sur le fil d'un couteau est assurée par divers types de cellules immunitaires:
Lymphocytes B
Les cellules plasmatiques B résidant au niveau de la lamina propria produisent des taux élevés d' anticorps IgA sécrétoires spécifiques. Ces IgA sont sécrétées dans la lumière de l'intestin à travers la couche épithéliale par transcytose. Premièrement, la cellule épithéliale se lie à un dimère d'IgA via un récepteur polymérique d'Ig sur le côté basolatéral et le transporte dans une vésicule dans l'espace luminal. Ensuite, le récepteur est clivé protéolytiquement et le dimère d'IgA est libéré avec une partie du récepteur appelée le composant sécrétoire . Le composant sécrétoire protège les anticorps sécrétés contre le milieu digestif dans l'intestin.
Un niveau élevé d'IgA sécrétoire résulte de l'interaction des cellules B et de l'antigène intestinal présentant la cellule dendritique (DC) en coopération avec la cellule T auxiliaire folliculaire (Tfh) dans les centres germinaux (GC) des patchs de Peyer. Il existe deux méthodes principales de production d'IgA 1) dépendant des cellules T résultant en sIgA avec une affinité et une spécificité élevées et 2) génération indépendante des cellules T de sIgA, qui utilise des cellules dendritiques et leur production de cytokines BAFF et APRIL. Les sIgAs produites indépendamment par les lymphocytes T ont une affinité plus faible et recouvrent principalement les commensaux. Les fonctions générales des IgA sécrétoires sont d'enrober l'une des bactéries intestinales (commensales ou pathogènes) pour altérer leur motilité et les empêcher d'entrer en contact prolongé et direct avec l'épithélium intestinal et le système immunitaire intestinal de l'hôte. C'est ce qu'on appelle l'exclusion immunitaire. Les IgA sécrétées se lient aux toxines bactériennes et les neutralisent également.
Lymphocytes T
Les cellules T CD4 + naïves se différencient en Treg ou en divers sous-ensembles de cellules T auxiliaires (Th1, Th2, Th17 ou Tfh). Dans le tissu lymphoïde associé à l'intestin, le processus de différenciation se produit via la présentation d'antigènes dérivés du microbiote intestinal par des cellules présentant l'antigène telles que les cellules dendritiques ou les cellules M dans les plaques de Peyer. Le processus typique d'une tolérance orale envers les antigènes alimentaires ingérés peut être décrit comme un échantillonnage luminal continu des antigènes par les CD et leur migration ultérieure suivie de l'amorçage des cellules T naïves dans les ganglions lymphatiques mésentériques pour devenir des cellules T immunosuppressives (Treg). Les antigènes ainsi reçus assurent une tolérance à leur égard. Le microbiote commensal active également la réponse immunitaire - de manière à empêcher le tissu intestinal de l'hôte de l'endommager par les réactions des cellules immunitaires. Le résultat final des populations de cellules T chez les individus en bonne santé diffère du spectre des cellules T résultant d'une infection aiguë ou d'une inflammation chronique. Une stimulation inappropriée (généralement par des bactéries filamenteuses segmentées - SFB ) de la réponse cellulaire chronique Th1 ou Th17 joue un rôle crucial dans les dommages pathologiques de l'hôte.
Plusieurs nouvelles cellules lymphoïdes associées à l'intestin ont été décrites. Ils sont d'origines différentes et suivent des processus de maturation différents mais partagent le même rôle GALT - répondre rapidement aux pathogènes et sécréter des cytokines effectrices. De tels systèmes de protection multicouches mettent en évidence la sensibilité des sites muqueux aux agents envahissants. La voie muqueuse est le moyen le plus fréquent d'introduire des infections pathogènes dans l'hôte. L'engagement robuste d'une variété de cellules lymphoïdes patrouillant la couche épithéliale reflète également la pression évolutive et la course aux armements entre les systèmes immunitaires et les agents pathogènes échappant à son contrôle.
Lymphocytes intraépithéliaux (IEL)
Les lymphocytes intraépithéliaux résidentiels et à longue durée de vie sont l'une des plus grandes populations de lymphocytes T du corps. Contrairement aux autres lymphocytes périphériques, les IEL ne circulent pas dans la circulation sanguine ou le système lymphatique mais résident dans la couche épithéliale de l'intestin. Un tel emplacement est très spécial en soi - les IEL patrouillent la condition dans une seule couche de cellules et ont un aspect dendritique. Ils constituent la première ligne de défense en cas de franchissement de la barrière épithéliale par l'agent pathogène. Les IEL englobent une diversité surprenante d'origines et se divisent en deux catégories principales - conventionnelles et non conventionnelles. Il est basé sur les propriétés de surface moléculaire et le lieu où ils acquièrent leur programme cytotoxique effecteur final.
Les IEL conventionnelles portent un récepteur TCR classique constitué de sous-unités α et β conjointement avec des co-récepteurs CD4 ou CD8. Ils représentent une minorité relative des IEL intestinales totales par rapport aux IEL non conventionnelles. Ils sont dérivés de cellules T naïves qui rencontrent des antigènes à la périphérie (généralement des antigènes affichés par DC dans les patchs de Peyer). Après cette activation, les IEL conventionnels expriment des molécules tropiques intestinales leur permettant de se loger dans les tissus intestinaux après leur trafic dans le flux lymphatique et le flux sanguin ultérieur. Les cellules intraépithéliales conventionnelles sont donc des cellules T mémoire effectrices résidant dans les tissus, capables de répondre rapidement avec une activité cytolytique et la libération de cytokines telles que INFy et TNF.
Les IEL non conventionnelles présentent la majorité des cellules IEL dans la couche épithéliale intestinale et acquièrent leur programme effecteur après avoir quitté le thymus en tant que cellules naïves et avoir rencontré des antigènes dans GALT. Après une telle stimulation, des IEL non conventionnelles (principalement des lymphocytes T γδ ) résident dans l'épithélium intestinal. Les cellules T γδ expriment le récepteur TCR constitué de sous-unités γ et δ et ne reconnaissent pas les peptides antigéniques présentés sous la forme liée au CMH. Le processus de leur activation est encore largement inconnu. La principale propriété des cellules T γδ est la formation de populations de mémoire à longue durée de vie dans les tissus barrières tels que l'épithélium intestinal ou dans la peau. Ils effectuent une mémoire immunitaire dans des tissus particuliers même après l'élimination de l'agent pathogène ou le retrait de l'inflammation.
Cellules lymphoïdes innées (ILC)
Les cellules lymphoïdes innées (ILC) sont la famille la plus récemment découverte de cellules immunitaires innées et le terme «innées» signifie qu'elles n'ont pas besoin de réarrangement du gène du récepteur d'antigène. En raison du développement d'une nouvelle méthode, telle que le séquençage d'ARN monocellulaire, des sous-types de cellules lymphoïdes innées sont décrits. Sur la base de leur profil transcriptionnel défini par les principaux facteurs de transcription, les ILC sont divisées en cinq sous-ensembles distincts: les cellules NK, les ILC1, les ILC2, les ILC3 et les cellules LTi. Les ILC sont répandues sur les surfaces muqueuses, jouant un rôle clé dans l'immunité muqueuse et l'homéostasie en raison de leur capacité de sécrétion rapide de cytokines immunorégulatrices et donc de communiquer avec d'autres cellules immunitaires.
L'immunité innée
Outre l'immunité spécifique adaptative, une immunité innée joue un rôle important dans GALT car elle fournit une réponse plus rapide. La reconnaissance de la non-auto-signature microbienne se produit par des récepteurs de reconnaissance de formes (PRR) qui peuvent être trouvés sur les cellules dendritiques, les macrophages, les monocytes, les neutrophiles et les cellules épithéliales. Les PRR se lient au motif microbien conservé comme les composants de la paroi cellulaire (LPS, acide teichoïque, flagelline, peptidoglycane) ou l'acide nucléique viral ou bactérien. Les PRR sont localisés de manière extracellulaire en tant que récepteurs liés à la membrane (récepteurs de type Toll) ou intracellulaires (récepteurs de type NOD et de type RIG). Une palette variée de récepteurs de reconnaissance de formes est activée par divers signaux nommés PAMP (motifs moléculaires associés aux pathogènes) ou par des signaux liés à des lésions tissulaires nommées DAMP (motifs moléculaires associés aux dommages).
Les macrophages
La majorité des cellules présentatrices d'antigène (APC) dans l'intestin sont dérivées des macrophages, qui ont un renouvellement très rapide. Les macrophages sont répandus dans la lamina propria et les couches profondes sous-muqueuses comme la couche musculaire. Les macrophages peuvent utiliser leurs dendrites transépithéliales (longues extensions cytoplasmiques) et contacter directement la couche épithéliale et prélever des bactéries luminales. Dans des conditions saines, les macrophages engloutissent les bactéries commensales et les débris cellulaires environnants, sécrètent de l'IL-10, conduisent la maturation du Treg et contribuent à l'homéostasie tissulaire. En raison de la faible expression des récepteurs de réponse innée et des molécules de surface co-stimulantes, les macrophages intestinaux ne déclenchent pas d'inflammation. Mais lors d'une infection ou d'une inflammation, le profil des macrophages change et ils commencent à sécréter de grandes quantités de TNF- α et deviennent des cellules effectrices pro-inflammatoires.
Cellules dendritiques
Les DC présentent moins de 10% de lamina propria APC et ne résident généralement pas dans les couches inférieures. La production inhérente d'acide rétinoïque et de TGF-β (typique pour les DC associées à l'intestin) induit l'expression de molécules de recherche intestinale et favorise le changement d'IgA pendant la maturation des cellules B dans les folicules. Les DC dirigent également les Treg et les IEL conventionnels pour qu'ils reçoivent leur phénotype final de cellules effectrices matures dans l'intestin.
Autres animaux
L' immunité adaptative , médiée par les anticorps et les cellules T , ne se trouve que chez les vertébrés . Alors que tous ont un tissu lymphoïde associé à l'intestin et que la grande majorité ont une version de la rate et du thymus , tous les vertébrés ne présentent pas de moelle osseuse , de ganglions lymphatiques ou de centres germinatifs , ce qui signifie que tous les vertébrés ne peuvent pas générer des lymphocytes dans la moelle osseuse. Cette distribution différente des organes adaptatifs dans les différents groupes de vertébrés suggère GALT comme la toute première partie du système immunitaire adaptatif chez les vertébrés. Il a été suggéré qu'à partir de ce GALT existant, et en raison de la pression exercée par les bactéries commensales dans l'intestin qui co-évoluaient avec les vertébrés, des spécialisations ultérieures telles que le thymus, la rate ou les ganglions lymphatiques sont apparues dans le cadre du système immunitaire adaptatif .
Images supplémentaires
Les références
Liens externes
- Image histologique: 12502loa - Système d'apprentissage de l'histologie à l'Université de Boston - "Système digestif: Canal alimentaire: côlon , taenia coli "
- Image histologique: 11102loa - Système d'apprentissage de l'histologie à l'Université de Boston - "Système digestif: Canal alimentaire: jonction œsophagienne / estomac"