Lovastatine - Lovastatin
 | |
 | |
| Donnée clinique | |
|---|---|
| Appellations commerciales | Mevacor, Altocor, autres |
| Autres noms | Monacolin K, Mevinolin |
| AHFS / Drugs.com | Monographie |
| MedlinePlus | a688006 |
| Données de licence | |
| Voies d' administration |
Par la bouche |
| code ATC | |
| Statut légal | |
| Statut légal | |
| Données pharmacocinétiques | |
| Biodisponibilité | <5% |
| Liaison protéique | >98 % |
| Métabolisme | Foie ( substrat du CYP3A et du CYP2C8 ) |
| Demi-vie d' élimination | 2 à 5 heures |
| Excrétion | Fèces (83%), urines (10%) |
| Identifiants | |
| |
| Numero CAS | |
| CID PubChem | |
| IUPHAR/BPS | |
| Banque de médicaments | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Tableau de bord CompTox ( EPA ) | |
| Carte d'information de l'ECHA |
100.115.931 |
| Données chimiques et physiques | |
| Formule | C 24 H 36 O 5 |
| Masse molaire | 404,547 g·mol -1 |
| Modèle 3D ( JSmol ) | |
| |
| |
| (Vérifier) | |
La lovastatine , vendue entre autres sous le nom de marque Mevacor , est un médicament à base de statine , destiné à traiter l'hypercholestérolémie et à réduire le risque de maladie cardiovasculaire . Son utilisation est recommandée avec des changements de style de vie. Il est pris par voie orale.
Les effets secondaires courants comprennent la diarrhée, la constipation, les maux de tête, les douleurs musculaires, les éruptions cutanées et les troubles du sommeil. Les effets secondaires graves peuvent inclure des problèmes de foie , une dégradation musculaire et une insuffisance rénale . L'utilisation pendant la grossesse peut nuire au bébé et l'utilisation pendant l' allaitement n'est pas recommandée. Il agit en diminuant la capacité du foie à produire du cholestérol en bloquant l'enzyme HMG-CoA réductase .
La lovastatine a été brevetée en 1979 et approuvée pour un usage médical en 1987. Elle figure sur la liste des médicaments essentiels de l'Organisation mondiale de la santé . Il est disponible sous forme de médicament générique . En 2019, c'était le 95e médicament le plus prescrit aux États-Unis, avec plus de 8 millions d'ordonnances.
Utilisations médicales
Les principales utilisations de la lovastatine sont le traitement de la dyslipidémie et la prévention des maladies cardiovasculaires . Il est recommandé de ne l'utiliser qu'après que d'autres mesures, telles que le régime alimentaire, l'exercice et la réduction de poids, n'ont pas amélioré le taux de cholestérol.
Effets secondaires
La lovastatine est généralement bien tolérée, les effets secondaires les plus courants étant, par ordre de fréquence approximativement décroissant : élévation de la créatine phosphokinase , flatulences , douleurs abdominales, constipation, diarrhée , douleurs musculaires , nausées, indigestion , faiblesse, vision trouble, éruption cutanée, vertiges et crampes musculaires. Comme avec tous les médicaments à base de statine, elle peut rarement provoquer une myopathie , une hépatotoxicité (atteinte hépatique), une dermatomyosite ou une rhabdomyolyse . Cela peut mettre la vie en danger s'il n'est pas reconnu et traité à temps. Par conséquent, toute douleur ou faiblesse musculaire inexpliquée pendant le traitement par la lovastatine doit être signalée rapidement au médecin prescripteur. D'autres effets indésirables peu fréquents qui doivent être rapidement signalés au médecin prescripteur ou à un service médical d'urgence comprennent :
- douleur musculaire, sensibilité ou faiblesse
- manque d'énergie
- la faiblesse
- fièvre
- urine de couleur foncée
- jaunisse : jaunissement de la peau ou des yeux
- douleur dans la partie supérieure droite de l'estomac
- la nausée
- saignements ou ecchymoses inhabituels
- perte d'appétit
- symptômes pseudo-grippaux
- éruption
- urticaire
- démangeaison
- difficulté à respirer ou à avaler
- gonflement du visage, de la gorge, de la langue, des lèvres, des yeux, des mains, des pieds, des chevilles ou du bas des jambes
- enrouement
Ces effets secondaires moins graves doivent tout de même être signalés s'ils persistent ou s'aggravent :
- constipation
- perte de mémoire ou oubli
- confusion
Contre-indications
Les contre - indications , les conditions qui justifient l'arrêt du traitement par la lovastatine, comprennent la grossesse, l'allaitement et les maladies du foie. La lovastatine est contre-indiquée pendant la grossesse (catégorie de grossesse X); il peut provoquer des malformations congénitales telles que des malformations squelettiques ou des troubles d'apprentissage. En raison de son potentiel de perturber le métabolisme lipidique du nourrisson, la lovastatine ne doit pas être prise pendant l'allaitement. Les patients atteints d'une maladie du foie ne doivent pas prendre de lovastatine.
Interactions
Comme avec l' atorvastatine , la simvastatine et d'autres statines métabolisées via le CYP3A4 , la consommation de jus de pamplemousse pendant le traitement par la lovastatine peut augmenter le risque d'effets secondaires. Les composants du jus de pamplemousse, le flavonoïde naringine ou la furanocoumarine bergamotine inhibent le CYP3A4 in vitro et peuvent expliquer l' effet in vivo du concentré de jus de pamplemousse diminuant la clairance métabolique de la lovastatine et augmentant ses concentrations plasmatiques.
Mécanisme d'action
La lovastatine est un inhibiteur de la 3-hydroxy-3-méthylglutaryl-coenzyme A réductase (HMG-CoA réductase), une enzyme qui catalyse la conversion de la HMG-CoA en mévalonate. Le mévalonate est un élément essentiel de la biosynthèse du cholestérol et la lovastatine interfère avec sa production en agissant comme un inhibiteur compétitif réversible de la HMG-CoA, qui se lie à la HMG-CoA réductase. La lovastatine est un promédicament , une lactone inactive sous sa forme native, la forme à cycle fermé gamma-lactone dans laquelle elle est administrée, est hydrolysée in vivo en la forme à cycle ouvert β-hydroxy acide ; qui est la forme active.
La lovastatine et d'autres statines ont été étudiées pour leurs effets chimiopréventifs et chimiothérapeutiques . Aucun effet de ce type n'a été observé dans les premières études. Des investigations plus récentes ont révélé des effets chimiopréventifs et thérapeutiques, pour certains types de cancer, en particulier en association de statines avec d'autres médicaments anticancéreux. Il est probable que ces effets sont médiés par les propriétés des statines pour réduire protéasome activité, ce qui conduit à une accumulation de kinase dépendante des cyclines inhibiteurs p21 et p27 , et à la suite G 1 arrêt -phase, comme on le voit dans les cellules de différentes lignées cancéreuses.
Histoire

La compactine et la lovastatine, des produits naturels ayant un puissant effet inhibiteur sur l' HMG-CoA réductase , ont été découvertes dans les années 1970 et mises en développement clinique en tant que médicaments potentiels pour abaisser le cholestérol LDL .
En 1982, des études cliniques à petite échelle sur la lovastatine, un produit naturel dérivé de polykétide isolé d' Aspergillus terreus , chez des patients à très haut risque ont été entreprises, au cours desquelles des réductions spectaculaires du cholestérol LDL ont été observées, avec très peu d'effets indésirables. Après que les études de sécurité animales supplémentaires avec la lovastatine n'ont révélé aucune toxicité du type supposé être associé à la compactine, les études cliniques se sont poursuivies.
Des essais à grande échelle ont confirmé l'efficacité de la lovastatine. La tolérance observée est restée excellente et la lovastatine a été approuvée par la FDA américaine en 1987. C'était la première statine approuvée par la FDA.
La lovastatine est également produite naturellement par certains champignons supérieurs , tels que Pleurotus ostreatus (huîtres) et Pleurotus spp. Les recherches sur l'effet du pleurote et de ses extraits sur les taux de cholestérol des animaux de laboratoire ont été approfondies, bien que l'effet ait été démontré chez un nombre très limité de sujets humains.
En 1998, la FDA a interdit la vente de compléments alimentaires dérivés de la levure de riz rouge , qui contient naturellement de la lovastatine, arguant que les produits contenant des agents de prescription nécessitent une approbation de médicament. Le juge Dale A. Kimball du tribunal de district des États-Unis pour le district de l'Utah a accueilli une requête du fabricant de Cholestin, Pharmanex, selon laquelle l'interdiction de l'agence était illégale en vertu de la loi de 1994 sur la santé et l'éducation des suppléments alimentaires, car le produit était commercialisé en tant que complément alimentaire. , pas un médicament.
L'objectif est de réduire les niveaux excessifs de cholestérol à un niveau compatible avec le maintien d'une fonction corporelle normale. Le cholestérol est biosynthétisé dans une série de plus de 25 réactions enzymatiques distinctes qui impliquent initialement trois condensations successives d'unités acétyl-CoA pour former le composé à six carbones 3-hydroxy-3-méthylglutaryl coenzyme A (HMG CoA). Celui-ci est réduit en mévalonate puis converti en une série de réactions en isoprènes qui sont les éléments constitutifs du squalène , le précurseur immédiat des stérols, qui se cyclise en lanostérol (un stérol méthylé) et est ensuite métabolisé en cholestérol. Un certain nombre de premières tentatives pour bloquer la synthèse du cholestérol ont abouti à des agents qui ont inhibé tardivement la voie de biosynthèse entre le lanostérol et le cholestérol. Une étape majeure limitant la vitesse de la voie se situe au niveau de l'enzyme microsomale qui catalyse la conversion de l'HMG CoA en acide mévalonique, et qui est considérée depuis plusieurs années comme une cible de choix pour une intervention pharmacologique.
L'HMG CoA réductase intervient tôt dans la voie de biosynthèse et fait partie des premières étapes engagées dans la formulation du cholestérol. L'inhibition de cette enzyme pourrait conduire à l'accumulation de HMG CoA, un intermédiaire hydrosoluble qui est alors capable d'être facilement métabolisé en molécules plus simples. Cette inhibition de la réductase conduirait à l'accumulation d'intermédiaires lipophiles avec un cycle stérol formel.
La lovastatine a été le premier inhibiteur spécifique de l'HMG CoA réductase à recevoir l'approbation pour le traitement de l'hypercholestérolémie. La première percée dans les efforts visant à trouver un inhibiteur puissant, spécifique et compétitif de la HMG CoA réductase a eu lieu en 1976, lorsque Endo et al. ont rapporté la découverte de la mévastatine , un métabolite fongique hautement fonctionnalisé, isolé de cultures de Penicillium citrium .
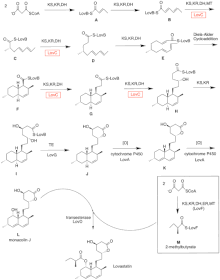
Biosynthèse
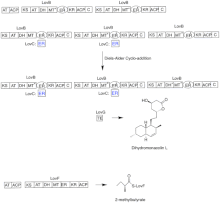
La biosynthèse de la lovastatine se produit via une voie itérative de type I polykétide synthase (PKS). Les six gènes qui codent pour des enzymes essentielles à la biosynthèse de la lovastatine sont lovB, lovC, lovA, lovD, lovG et lovF. La synthèse de la dihydromonacoline L nécessite un total de 9-malonyl Coa. Il procède dans la voie PKS jusqu'à ce qu'il atteigne (E) un hexakétide, où il subit une cycloaddition Diels-Alder pour former les anneaux fusionnés. Après la cyclisation, il continue à travers la voie PKS jusqu'à ce qu'il atteigne (I) un nonakétide, qui subit ensuite la libération de LovB via la thioestérase codée par LovG. La dihydromonacoline L, (J), subit ensuite une oxydation et une déshydratation via une cytochrome P450 oxygénase codée par LovA pour obtenir la monacoline J, (L) .
Le domaine MT de lovB est actif dans la conversion de ( B) en ( C) lorsqu'il transfère un groupe méthyle de la S-adénosyl-L-méthionine (SAM) au tétracétide (C) . En raison du fait que LovB contient un domaine ER inactif, LovC est requis à des étapes spécifiques pour obtenir des produits entièrement réduits. L'organisation des domaines de LovB, LovC, LovG et LovF est illustrée à la figure 2. Le domaine ER inactif de lovB est représenté par un ovale et où LovC agit en trans vers LovB est représenté par un cadre rouge.
Dans une voie parallèle, la chaîne latérale dicétide de la lovastatine est synthétisée par une autre enzyme polykétide synthase de type I hautement réductrice codée par LovF . Enfin, la chaîne latérale, le 2-méthylbutyrate (M) est liée de manière covalente au groupe hydroxy C-8 de la monacoline J (L) par une transestérase codée par LovD pour former la lovastatine.
Synthèse totale
L'essentiel des travaux de synthèse de la lovastatine a été réalisé par M. Hirama dans les années 1980. Hirama a synthétisé la compactine et a utilisé l'un des intermédiaires pour suivre un chemin différent pour arriver à la lovastatine. La séquence synthétique est représentée dans les schémas ci-dessous. La -lactone a été synthétisée en utilisant la méthodologie Yamada en commençant par l'acide glutamique. L' ouverture de lactone a été effectuée en utilisant du méthoxyde de lithium dans du méthanol , puis une silylation pour donner un mélange séparable de la lactone de départ et de l' éther de silyle . L'éther de silyle sur hydrogénolyse suivie d'une oxydation de Collins a donné l'aldéhyde. La préparation stéréosélective de (E,E)-diène a été réalisée par addition d'anion trans-crotyl phénylsulfone, suivie d'une trempe avec Ac 2 O et d'une élimination réductrice subséquente de l'acétate de sulfone. La condensation de celui-ci avec l'anion lithium du méthylphosphonate de diméthyle a donné le composé 1. Le composé 2 a été synthétisé comme indiqué dans le schéma de la procédure de synthèse. Les composés 1 et 2 ont ensuite été combinés en utilisant 1,3 éq d'hydrure de sodium dans du THF suivi d'un reflux dans du chlorobenzène pendant 82 heures sous azote pour obtenir l'énone 3.
Des réactions organiques simples ont été utilisées pour obtenir la lovastatine comme indiqué dans le schéma.
Société et culture
Sources naturelles
La lovastatine est un composé naturel présent en faibles concentrations dans les aliments tels que les pleurotes , la levure de riz rouge et le Pu-erh .
Les noms de marques
Mevacor, Advicor (en association avec la niacine ), Altocor, Altoprev
Autres applications
En physiologie végétale, la lovastatine a parfois été utilisée comme inhibiteur de la biosynthèse des cytokinines .
Voir également
Les références
Liens externes
![]() Médias liés à la lovastatine sur Wikimedia Commons
Médias liés à la lovastatine sur Wikimedia Commons
- "Lovastatine" . Portail d'information sur les médicaments . Bibliothèque nationale de médecine des États-Unis.