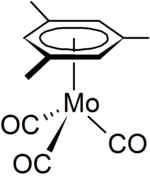Mésitylène - Mesitylene
|
|
|||
| Noms | |||
|---|---|---|---|
|
Nom IUPAC préféré
1,3,5-Triméthylbenzène |
|||
| Autres noms
Mésitylène
sym -Trimethylbenzene |
|||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| ChEBI | |||
| ChemSpider | |||
| Carte d'information de l'ECHA |
100.003.278 |
||
| Numéro CE | |||
| KEGG | |||
|
CID PubChem
|
|||
| UNII | |||
| Numéro ONU | 2325 | ||
|
Tableau de bord CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriétés | |||
| C 9 H 12 | |||
| Masse molaire | 120,19 g/mol | ||
| Apparence | Liquide clair et incolore | ||
| Odeur | Distinctif, aromatique | ||
| Densité | 0,8637 g / cm 3 à 20 ° C | ||
| Point de fusion | −44,8 °C (−48,6 °F; 228,3 K) | ||
| Point d'ébullition | 164,7 °C (328,5 °F; 437,8 K) | ||
| 0,002 % (20°C) | |||
| La pression de vapeur | 2 mmHg (20°C) | ||
| -92,32·10 -6 cm 3 /mol | |||
| Structure | |||
| 0,047 D | |||
| Dangers | |||
| Fiche de données de sécurité | [1] | ||
| point de rupture | 50 °C; 122 °F; 323 K | ||
| NIOSH (limites d'exposition pour la santé aux États-Unis) : | |||
|
PEL (Autorisé)
|
rien | ||
|
REL (recommandé)
|
TWA 25 ppm (125 mg/m 3 ) | ||
|
IDLH (Danger immédiat)
|
ND | ||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Références de l'infobox | |||
Le mésitylène ou 1,3,5-triméthylbenzène est un dérivé du benzène avec trois substituants méthyle positionnés symétriquement autour du cycle. Les deux autres triméthylbenzènes isomères sont le 1,2,4-triméthylbenzène (pseudocumène) et le 1,2,3-triméthylbenzène (hémimellitène). Les trois composés ont la formule C 6 H 3 (CH 3 ) 3 , qui est communément abrégée C 6 H 3 Me 3 . Le mésitylène est un liquide incolore à l'odeur aromatique douce. C'est un composant du goudron de houille , qui est sa source traditionnelle. C'est un précurseur de diverses chimies fines . Le groupe mésityle (Mes) est un substituant de formule C 6 H 2 Me 3 et se trouve dans divers autres composés.
Préparation
Le mésitylène est préparé par équilibrage du xylène (ou par simple méthyl alkylation de celui-ci) sur un catalyseur acide solide :
- 2 C 6 H 4 (CH 3 ) 2 C 6 H 3 (CH 3 ) 3 + C 6 H 5 CH 3
- C 6 H 4 (CH 3 ) 2 + CH 3 OH → C 6 H 3 (CH 3 ) 3 + H 2 O
La trimérisation de l' acétone par condensation d'aldol , qui est catalysée et déshydratée par l'acide sulfurique, donne un mélange de 1,3,5- et 1,2,4-triméthylbenzènes.
Réactions
Oxydation de mésitylène avec l' acide nitrique donne l' acide trimésique , C 6 H 3 (COOH) 3 . En utilisant du dioxyde de manganèse , un agent oxydant plus doux , le 3,5-diméthyl benzaldéhyde se forme. Le mésitylène est oxydé par l'acide trifluoroperacétique pour produire du mésitol (2,4,6-triméthylphénol).
Applications
Le mésitylène est principalement utilisé comme précurseur de la 2,4,6-triméthylaniline , précurseur des colorants. Ce dérivé est préparé par mononitration sélective du mésitylène, évitant l'oxydation des groupements méthyle.
Additif et composant de certains mélanges d'essence aviation (essence d'aviation).
Utilisations de niche
Le mésitylène est utilisé en laboratoire comme solvant de spécialité. Il peut également agir comme ligand en chimie organométallique , un exemple étant le complexe organomolybdène [( η 6 -C 6 H 3 Me 3 )Mo(CO) 3 ]. qui peut être préparé à partir d' hexacarbonyle de molybdène .
Dans l'industrie électronique, le mésitylène a été utilisé comme révélateur pour les silicones photomodelables en raison de ses propriétés de solvant.
Les trois atomes d'hydrogène aromatiques du mésitylène se trouvent dans des environnements de déplacement chimique identiques. Par conséquent, ils ne donnent qu'un seul pic proche de 6,8 ppm dans le spectre RMN 1 H ; il en est de même pour les neuf protons méthyle , qui donnent un singulet proche de 2,3 ppm. Pour cette raison, le mésitylène est parfois utilisé comme étalon interne dans les échantillons RMN contenant des protons aromatiques.
L'acide uvitique est obtenu par oxydation du mésitylène ou par condensation de l'acide pyruvique avec de l'eau barytée .
La réaction de Gattermann peut être simplifiée en remplaçant la combinaison HCN/AlCl 3 par du cyanure de zinc (Zn(CN) 2 ). Bien qu'il soit hautement toxique, le Zn(CN) 2 est un solide, ce qui le rend plus sûr à utiliser que le cyanure d'hydrogène gazeux (HCN). Le Zn(CN) 2 réagit avec le HCl pour former le réactif HCN clé et le Zn(CN) 2 qui sert de catalyseur d'acide de Lewis in situ . Un exemple de la méthode Zn(CN) 2 est la synthèse de mésitaldéhyde à partir de mésitylène.
Histoire
Le mésitylène a été préparé pour la première fois en 1837 par Robert Kane , un chimiste irlandais, en chauffant de l'acétone avec de l'acide sulfurique concentré. Il a nommé sa nouvelle substance « mésitylène » parce que le chimiste allemand Carl Reichenbach avait nommé l'acétone « mesit » (du grec μεσίτης, le médiateur), et Kane croyait que sa réaction avait déshydraté le mesit, le convertissant en un alcène , « mésitylène ». Cependant, la détermination de Kane de la composition chimique ("formule empirique") du mésitylène était incorrecte. La formule empirique correcte a été fournie par August W. von Hofmann en 1849. En 1866, Adolf von Baeyer a montré que la structure du mésitylène était cohérente avec celle du 1,3,5-triméthylbenzène ; Cependant, la preuve concluante que le mésitylène était identique au 1,3,5-triméthylbenzène a été fournie par Albert Ladenburg en 1874.
Groupe mésityle
Le groupe (CH 3 ) 3 C 6 H 2 - est appelé mésityle (symbole du groupe organique : Mes). Les dérivés mésityle, par exemple tetramesityldiiron , sont typiquement préparés à partir du réactif de Grignard (CH 3 ) 3 C 6 H 2 MgBr. En raison de sa forte demande stérique, le groupe mésityle est utilisé comme grand groupe bloquant dans la catalyse asymétrique (pour améliorer la diastéréo- ou l'énantiosélectivité) et la chimie organométallique (pour stabiliser les centres métalliques à faible état d'oxydation ou à faible nombre de coordination). Des analogues plus gros avec une demande stérique encore plus grande, par exemple le 2,6-diisopropylphényl (Dipp) et le Tripp (( i Pr) 3 C 6 H 2 , Is) et le supermésityl (( t Bu) 3 C 6 H 2 , Mes *) groupes, peut être encore plus efficace pour atteindre ces objectifs.
Sécurité et environnement
Le mésitylène est également un important composé organique volatil (COV) urbain qui résulte de la combustion . Il joue un rôle important dans la formation des aérosols et de l'ozone troposphérique ainsi que dans d'autres réactions de la chimie atmosphérique .
Les références
- ^ a b Nomenclature de chimie organique : recommandations IUPAC et noms préférés 2013 (Livre bleu) . Cambridge : La Société royale de chimie . 2014. p. 139. doi : 10.1039/9781849733069-FP001 . ISBN 978-0-85404-182-4.
- ^ A b c d e f g h NIOSH Guide de poche dangers des produits chimiques. "#0639" . Institut national pour la sécurité et la santé au travail (NIOSH).
- ^ Zhao, juin; Zhang, Renyi (2004). « Constantes de taux de réaction de transfert de protons entre l'ion hydronium (H 3 O + ) et les composés organiques volatils ». Environnement atmosphérique . 38 (14) : 2177-2185. Bibcode : 2004AtmEn..38.2177Z . doi : 10.1016/j.atmosenv.2004.01.019 .
- ^ un b Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke "Hydrocarbures" dans Ullmann's Encyclopedia of Industrial Chemistry 2002 Wiley-VCH, Weinheim. doi : 10.1002/14356007.a13_227 .
- ^ Cumming, WM (1937). Chimie organique systématique (3E) . New York, États-Unis : D. Van Nostrand Company. p. 57.
- ^ Chambres, Richard D. (2004). "Composés fonctionnels contenant de l'oxygène, du soufre ou de l'azote et leurs dérivés" . Le fluor en chimie organique . CRC Appuyez sur . p. 242–243. ISBN 9780849317903.
- ^ Gerald Booth (2007). "Composés Nitro, Aromatiques". Encyclopédie de chimie industrielle d'Ullmann . Weinheim : Wiley-VCH. doi : 10.1002/14356007.a17_411 . ISBN 978-3527306732.
- ^ Girolami, GS ; Rauchfuss, TB et Angelici, RJ, Synthèse et technique en chimie inorganique, University Science Books: Mill Valley, CA, 1999. ISBN 0-93570248-2 .
- ^ "Mesitylene (1,3,5-Trimethyl Benzene)" .
- ^ "Définition de l'acide uvitique" . merriam-webster.com . Consulté le 31 octobre 2016 .
- ^ Adams R. ; Levine, I. (1923). « Simplification de la synthèse Gattermann d'hydroxyaldéhydes ». Confiture. Chem. Soc. 45 (10) : 2373-77. doi : 10.1021/ja01663a020 .
- ^ Adams, Roger (1957). Réactions organiques, tome 9 . New York : John Wiley & Sons, Inc. pp. 38 & 53-54. doi : 10.1002/0471264180.ou009.02 . ISBN 9780471007265.
- ^ Fuson, RC; Horning, CE; Rowland, SP; Ward, ML (1955). "Mésitaldéhyde". Synthèses organiques . doi : 10.15227/orgsyn.023.0057 .; Volume collectif , 3 , p. 549
- ^ Robert Kane (1839) "Sur une série de combinaisons dérivées de l'esprit pyroacétique [acétone]" Transactions of the Royal Irish Academy , vol. 18, pages 99-125.
- ^ Les recherches de Reichenbach sont extraites de : C. Reichenbach (1834) "Ueber Mesit (Essiggeist) und Holzgeist" (On mesit (esprit de vinaigre) et alcools de bois), Annalen der Pharmacie , vol. 10, non. 3, pages 298-314.
- ^ Pour une explication de l'original du nom « mésitylène », voir aussi : Henry E. Roscoe, A Treatise on Chemistry (New York, New York : D. Appleton and Co., 1889), vol. III, page 102 , note de bas de page 2.
- ^ AW Hofmann (1849) "Sur la composition du mésitilole [mésitylène] et de certains de ses dérivés", The Quarterly Journal of the Chemical Society of London , vol. 2, pages 104–115 . (Remarque : La formule empirique du mésitylène telle qu'elle est indiquée dans l'article de Hofmann ( C 18 H 12 ) est incorrecte ; cependant, cela s'est produit parce que Hofmann a utilisé 6 comme poids atomique du carbone, au lieu du poids atomique correct de 12. Une fois le poids atomique correct poids est utilisé dans les calculs de Hofmann, ses résultats donnent la formule empirique correcte de C 9 H 12 .)
- ^ Adolf von Baeyer (1866) "Ueber die Condensationsproducte des Acetons" (Sur les produits de condensation de l'acétone), Annalen der Chemie und Pharmacie , vol. 140, pages 297-306.
- ^ Albert Ladenburg (1874) « Ueber das Mesitylen » (Sur le mésitylène), Berichte der deutschen chemischen Gesellschaft , vol. 7, pages 1133-1137. doi : 10.1002/cber.18740070261