Acide trifluoropéracétique - Trifluoroperacetic acid
|
|
| Des noms | |
|---|---|
|
Nom IUPAC préféré
Acide trifluoroéthane peroxoïque |
|
| Autres noms | |
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
|
|
|
|
| Propriétés | |
| C 2 H F 3 O 3 | |
| Masse molaire | 130,022 g · mol −1 |
| Apparence | liquide incolore |
| Point d'ébullition | 162 ° C (324 ° F; 435 K) |
| Solubilité | soluble dans l' acétonitrile , le dichlorométhane , l'éther diéthylique , le sulfolane |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|
| Références Infobox | |
L'acide trifluoroperacétique ( acide trifluoroperoxyacétique , TFPAA ) est un composé organofluoré , l' analogue peroxyacide de l'acide trifluoroacétique , de formule développée condensée CF
3 COOOH . C'est un oxydant puissant pour les réactions d' oxydation organique , comme dans les oxydations de Baeyer – Villiger des cétones . C'est le plus réactif des peroxyacides organiques, ce qui lui permet d'oxyder avec succès des alcènes relativement non réactifs en époxydes là où d'autres peroxyacides sont inefficaces. Il peut également oxyder les chalcogènes de certains groupes fonctionnels, comme par exemple en transformant des sélénoéthers en selones . Il s'agit d'un matériau potentiellement explosif et n'est pas disponible dans le commerce, mais il peut être rapidement préparé selon les besoins. Son utilisation comme réactif de laboratoire a été lancée et développée par William D. Emmons .
Propriétés
A température et pression ambiantes standard , l'acide trifluoropéracétique est un liquide incolore avec un point d'ébullition de 162 ° C. Il est soluble dans l' acétonitrile , le dichlorométhane , l'éther diéthylique et le sulfolane et réagit facilement avec l'eau. Comme tous les peroxyacides, il est potentiellement explosif et nécessite une manipulation soigneuse. Il n'est pas disponible dans le commerce, mais peut être fabriqué en laboratoire et conservé jusqu'à plusieurs semaines à -20 ° C. Certaines méthodes de préparation aboutissent à des mélanges contenant du peroxyde d'hydrogène résiduel et de l'acide trifluoroacétique , et le chauffage d'un tel mélange est extrêmement dangereux; le peroxyde d'hydrogène peut être décomposé en utilisant du dioxyde de manganèse pour des raisons de sécurité avant le chauffage.
Préparation
L'acide trifluoropéracétique peut être facilement préparé par un procédé de synthèse organique consistant à traiter l'anhydride trifluoroacétique avec une solution aqueuse concentrée (90%) de peroxyde d'hydrogène:
-
CF
3 COOCOCF
3 + H
2 O
2 → CF
3 COOOH + CF
3 COOH
Comme l'anhydride formera de l'acide trifluoroacétique au contact de l'eau, un excès d'anhydride sert également à éliminer le solvant du réactif peroxyde:
-
CF
3 COOCOCF
3 + H
2 O → 2 CF
3 COOH
Une solution de peroxyde d'hydrogène plus diluée (30%) peut être utilisée pour former de l'acide trifluoropéracétique pour certaines réactions à partir de l'acide trifluoroacétique.
-
CF
3 COOH + H
2 O
2 → CF
3 COOOH + H
2 O
Afin d'éviter le danger de manipuler des solutions pures ou hautement concentrées de peroxyde d'hydrogène, le peroxyde d'hydrogène - urée peut être utilisé pour donner le peracide. Cette méthode n'implique pas d'eau, elle donne donc un peracide complètement anhydre , ce qui est un avantage lorsque la présence d'eau entraîne des réactions secondaires lors de certaines réactions d'oxydation.
-
CF
3 COOCOCF
3 + H
2 O
2 · CO (NH
2 )
2 → CF
3 COOOH + CF
3 COOH + CO (NH
2 )
2
Dans les cas où un agent tampon de pH est nécessaire pour une synthèse et où la présence d'eau est tolérée, une autre approche a été développée. Réaction de l'anhydride trifluoroacétique avec du percarbonate de sodium , 2Na
2 CO
3 · 3H
2 O
2 , donne de l'acide trifluoropéracétique et du carbonate de sodium , évitant ainsi la nécessité d'un tampon supplémentaire.
- 3 CF
3 COOCOCF
3 + 4 Na
2 CO
3 · 1 1 / deux H
2 O
2 → 6 CF
3 COOOH + 4 Na
2 CO
3 + 3 H
2 O
L'acide trifluoropéracétique peut également être généré in situ , lui permettant de réagir rapidement avec le substrat cible plutôt que de pré-synthétiser un lot de réactif pour une utilisation ultérieure.
Les usages
L'acide trifluoropéracétique est principalement utilisé comme agent oxydant . En septembre 1953, le Journal of the American Chemical Society a publié des travaux de William D. Emmons et Arthur F. Ferris rapportant que ce réactif, généré in situ , était capable d'oxyder l' aniline en nitrobenzène . Au cours des deux années suivantes, Emmons a rapporté une méthode de préparation pour ce réactif et a publié six autres manuscrits dans ce journal sur ses applications; On se souvient en partie d'Emmons comme du pionnier et du développeur de l'acide trifluoropéracétique en tant que réactif de laboratoire, qui est depuis devenu utile comme réactif pour de nombreux types de réactions synthétiques.
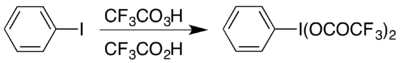
Un exemple est la formation de l' iode hypervalent composé (bis (trifluoroacétoxy) iodo) benzène , (CF
3 ROUCOULER)
2 IC
6 H
5 qui est utilisé pour effectuer le réarrangement de Hofmann dans des conditions acides. Le composé hypervalent est accessible de deux manières, et celui qui est choisi dépend généralement des matériaux disponibles: il peut être préparé à partir de son analogue acétate par une réaction d'échange, ou en faisant réagir l' iodobenzène avec une combinaison d'acide trifluoroperacétique et d'acide trifluoroacétique:
Oxydation de Baeyer – Villiger
L'acide trifluoropéracétique est l'un des réactifs les plus puissants utilisés pour les oxydations de Baeyer – Villiger, en raison de sa forte acidité par rapport aux peracides et peroxydes similaires . Cette réaction convertit les cétones en esters à chaîne droite ou en lactones , et est nommée pour Adolf von Baeyer et Victor Villiger , qui l'ont signalé pour la première fois en 1899. On pense que la réaction se déroule via un intermédiaire Criegee et démontre une bonne régiosélectivité et chimiosélectivité pour la position de l'insertion d'atomes d'oxygène, ainsi que la rétention de la stéréochimie à la position adjacente, comme on peut le voir dans l'exemple suivant. Le phosphate disodique ( Na
2 HPO
4 ) est ajouté en tant que tampon de pH pour empêcher le sous-produit d'acide trifluoroacétique hautement acide de provoquer une hydrolyse ou une transestérification du produit ester.
Époxydation
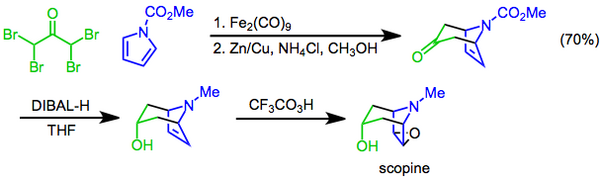
La réaction de Prilezhaev implique la conversion d'un alcène en un époxyde en utilisant un peracide comme oxydant et a été rapportée pour la première fois en 1909. La réaction a été utilisée comme étape finale de la synthèse de la scopine , un alcaloïde tropane . Dans cette approche, une cycloaddition [4 + 3] médiée par diiron nonacarbonyle est utilisée pour construire le squelette bicyclique, la fonction hydroxyle est ensuite introduite par réduction diastéréosélective de la cétone avec de l'hydrure de diisobutylaluminium , et la préparation complétée par une époxydation d'acide trifluoroperacétique de Prilezhaev .
La réactivité élevée de l'acide trifluoropéracétique par rapport aux autres peroxyacides lui permet d'oxyder avec succès des alcènes relativement pauvres en électrons tels que le 1-hexène et les esters α, β-insaturés tels que le méthacrylate de méthyle , substrats généralement résistants à l'époxydation peroxyacide. L'inclusion d'acide trifluoroacétique tamponné supplémentaire dans le mélange donne une structure hydroxy-trifluoroacétate vicinale au lieu d'un époxyde, qui peut être converti en diol par traitement avec du méthanol acide , comme dans la conversion suivante du 1-dodécène en 1,2-dodécanediol.
Dans le cas d'un composé d' alcool allylique avec un groupe fonctionnel carbonyle proche , l'époxyde peut subir une réaction d'expansion de cycle pour former un dioxolane . Le procédé ci-dessous a été utilisé dans le cadre de la synthèse totale du néosporol , un produit naturel :
La préparation du composé isomère sporol impliquait une formation similaire de dioxolane. Dans ce cas, l'utilisation d'acide trifluoropéracétique dérivé du peroxyde d'hydrogène, qui contenait donc vraisemblablement des traces d'eau, a donné principalement un hémiacétal plutôt que le dioxolane à cycle fermé. L'utilisation du complexe d'urée, qui a donné un matériau sans eau, a donné avec succès le dioxolane comme produit principal. Le dioxolane est étendu au système 1,3-dioxane trouvé dans le sporol à une étape ultérieure de la synthèse.
Oxydation des hétéroatomes
Les groupes fonctionnels contenant des hétéroatomes dans des états de faible oxydation peuvent être oxydés par l'acide trifluoropéracétique. Les cas courants incluent l'oxydation de l'iode (par exemple, la formation du composé d'iode hypervalent à partir de l'iodobenzène mentionné précédemment), de l'azote, du soufre et du sélénium.
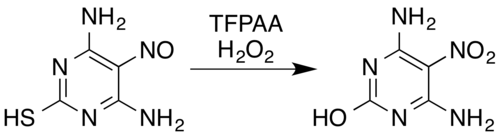
Dans le cas des composés contenant de l'azote, les transformations connues comprennent les oximes et les amines primaires aromatiques en composés nitro (même avec des substituants attracteurs d' électrons , par exemple, la pentafluoroaniline en pentafluoronitrobenzène), les nitrosamines en nitramines , la formation de N -oxydes aromatiques et d' azine N aromatique -oxydes et conversion des composés nitroso en composés nitro ou nitramines. Par exemple, un mélange de peroxyde d'hydrogène et d'acide trifluoropéracétique oxyde la pyrimidine 4,6-diamino-5-nitrosopyrimidine-2-thiol nitroso-substituée en son analogue nitro tout en éliminant également la partie thiol par désulfuration hydrolytique oxydative :
Dans le cas des éléments chalcogènes , les groupements sulfure (R – S – R) peuvent être oxydés par l'acide trifluoropéracétique en formes sulfoxyde (R – S (O) –R) et / ou sulfone (R – S (O) 2 –R) , en fonction des conditions utilisées. Dans le système sélénium analogue, l'oxydation par l'acide trifluoropéracétique des sélénoéthers (R – Se – R) produit selones (R – Se (O) 2 –R) sans formation des sélénoxydes apparentés (R – Se (O) –R) en tant que produit isolable, réaction particulièrement efficace lorsque le R est un groupe aryle . Une approche générale de la formation de chlorures de sulfinyle (RS (O) Cl) est la réaction du thiol correspondant avec le chlorure de sulfuryle ( SO
2 Cl
2 ). Dans les cas où le chlorure de sulfényle (RSCL) Résultats de la place, une oxydation ultérieure de l' acide trifluoroperacétique donne le produit désiré, comme dans le cas de 2,2,2-trifluoro-1,1-diphényl éthane - thiol :
L'oxydation à l'acide trifluoropéracétique du thiophène illustre des voies de réaction concurrentes, la S -oxydation et l'époxydation étant possibles. La voie principale forme initialement le sulfoxyde, mais ce produit chimique subit rapidement une dimérisation de type Diels-Alder avant toute nouvelle oxydation - ni le thiophène- S -oxyde ni le thiophène- S , S- dioxyde ne se trouvent parmi les produits de la réaction. Le dimère peut ensuite être davantage oxydé, en convertissant l'un des fragments S- oxyde en un S , S- dioxyde. Dans la voie de réaction mineure, une époxydation de Prilezhaev entraîne la formation de thiophène-2,3-époxyde qui se réorganise rapidement en l' isomère thiophène-2-one. Les expériences de piégeage démontrent que cette voie de l'époxyde n'est pas une réaction alternative de l' intermédiaire S -oxyde, et les expériences de marquage isotopique démontrent qu'un changement de 1,2-hydrure (un changement de NIH ) se produit et donc qu'un intermédiaire cationique est impliqué. Le choix de la méthode de préparation de l'acide trifluoropéracétique est important car l'eau supprime la voie de réaction mineure, probablement parce qu'elle agit comme une base concurrente.
Oxydation avec réarrangement acide
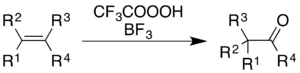
L'utilisation d'acide trifluoropéracétique avec du trifluorure de bore provoque l'oxydation des alcènes et des cycles aromatiques avec réarrangement concomitant du squelette moléculaire.
Pour les alcènes, la réaction donne un produit cétonique, bien que le processus mécaniste ne soit pas simplement une époxydation suivie d'un réarrangement de Wagner – Meerwein catalysé par BF 3 :
Pour les aromatiques, un exemple démontré dans un rapport sur les synthèses organiques est la conversion du 1,2,3,4,5,6- hexaméthylbenzène en 2,3,4,5,6,6-hexaméthyl-2,4-cyclohexadiénone:
Clivage oxydatif des arènes
En plus de la simple oxydation des cycles aromatiques pour former des composés carbonylés (voir § Oxydation avec réarrangement acide ), l'acide trifluoropéracétique peut complètement cliver les liaisons carbone-carbone dans le cycle. Contrairement à d'autres oxydations de structures alkylaromatiques , qui donnent des acides benzoïques et des composés apparentés par clivage de la chaîne alkyle en position benzylique réactive , l'acide trifluoroperacétique provoque une «oxydation inverse», clivant le cycle aromatique lui-même tout en laissant le groupe alkyle intact.
Cette sélectivité pour certains types de liaisons lui permet d'être utilisée pour décomposer des mélanges complexes d'hydrocarbures, comme le charbon , afin de déterminer les détails structurels.
Les systèmes aromatiques contenant des hétéroatomes sont résistants à cette ouverture de cycle car l'oxydation des hétéroatomes se produit préférentiellement et désactive le cycle vers l'attaque électrophile par le peroxyacide. Par exemple, les purines , pyridines et quinoléines forment à la place N -oxydes, tandis que les systèmes de soufre comme octafluoro dibenzothiophène sont convertis en sulfones.
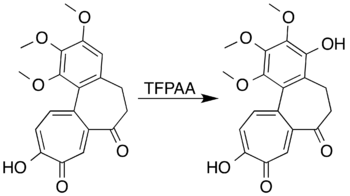
Les systèmes aromatiques avec des substituants d'activation de cycle peuvent être oxydés pour former des phénols au lieu de subir une réaction d'ouverture de cycle. Le mésitylène , par exemple, réagit avec l'acide trifluoropéracétique pour former du mésitol (2,4,6-triméthylphénol). Les chercheurs tentant de former une lactone par oxydation Baeyer-Villiger de la 7-oxodéacétamido colchicine n'ont pas été en mesure de préparer le produit souhaité, mais ont réussi à oxyder le cycle aromatique pour produire un dérivé phénolique avec un rendement élevé:
Remarques
Les références