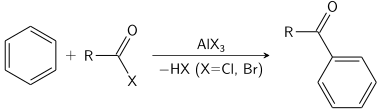Substitution aromatique électrophile - Electrophilic aromatic substitution
La substitution aromatique électrophile est une réaction organique dans laquelle un atome lié à un système aromatique (généralement l'hydrogène) est remplacé par un électrophile . Parmi les plus importants sont substitution électrophile aromatique nitration aromatique , halogénation aromatique , sulfonation aromatique , et l' alkylation et l' acylation réaction de Friedel-Crafts .
Réactions illustratives
L'exemple le plus répandu de cette réaction est l'éthylation du benzène.
Environ 24 700 000 tonnes ont été produites en 1999. (Après déshydrogénation et polymérisation, le polystyrène plastique de base est produit.) Dans ce processus, des acides sont utilisés comme catalyseur pour générer le carbocation naissant. De nombreuses autres réactions électrophiles du benzène sont conduites, bien qu'à une échelle beaucoup plus petite; ce sont des routes précieuses vers des intermédiaires clés. La nitration du benzène est obtenue via l'action de l' ion nitronium en tant qu'électrophile. La sulfonation avec de l'acide sulfurique fumant donne de l'acide benzènesulfonique . L'halogénation aromatique avec du brome , du chlore ou de l' iode donne les halogénures d'aryle correspondants. Cette réaction est typiquement catalysée par le trihalogénure de fer ou d'aluminium correspondant.
La réaction de Friedel – Crafts peut être réalisée soit sous forme d' acylation, soit sous forme d' alkylation . Souvent, le trichlorure d'aluminium est utilisé, mais presque n'importe quel acide de Lewis fort peut être appliqué. Pour la réaction d'acylation, une quantité stoechiométrique de trichlorure d'aluminium est nécessaire.
Mécanisme de réaction
Le mécanisme de réaction global, désigné par le symbole mécaniste de Hughes – Ingold S E Ar , commence par l'anneau aromatique attaquant l'électrophile E + . Cette étape conduit à la formation d'un cation cyclohexadiényle chargé positivement et délocalisé , également appelé ion arénium , intermédiaire Wheland ou complexe arène σ. De nombreux exemples de ce carbocation ont été caractérisées, mais dans des conditions normales de fonctionnement de ces espèces fortement acides donneront le proton fixé au sp 3 carbone au solvant (ou toute autre base faible) pour rétablir l' aromaticité. Le résultat net est le remplacement de H par E dans le cycle aryle. Parfois, d'autres électrofugeuses (groupes qui peuvent partir sans leur paire d'électrons ) à côté de H + partiront pour rétablir l'aromaticité; ces espèces comprennent des groupes silyle (comme SiR 3 + ), le groupe carboxy (comme CO 2 + H + ), le groupe iodo (comme I + ) et des groupes alkyle tertiaire comme t- butyle (comme R + ). La capacité de départ de ces types de substituants est parfois exploitée de manière synthétique, notamment dans le cas du remplacement du silyle par un autre groupement fonctionnel ( ipso attaque). Cependant, la perte de groupes comme iodo ou alkyle est plus souvent une réaction secondaire indésirable.
Effet des groupes substituants
La régiosélectivité - les divers modèles de substitution arène - et la vitesse d'une substitution aromatique électrophile sont affectées par les substituants déjà attachés au cycle benzénique. En termes de régiosélectivité, certains groupes favorisent la substitution aux positions ortho ou para, tandis que d'autres groupes privilégient la substitution à la position méta. Ces groupes sont appelés respectivement direction ortho – para ou méta direction . De plus, certains groupes augmenteront la vitesse de réaction ( activation ) tandis que d'autres diminueront la vitesse ( désactivation ). Alors que les modèles de régiosélectivité peuvent être expliqués avec des structures de résonance , l'influence sur la cinétique peut être expliquée à la fois par les structures de résonance et par l' effet inductif .
Taux de réaction
Les substituants peuvent généralement être divisés en deux classes concernant la substitution électrophile: l'activation et la désactivation vers le cycle aromatique. Activation des substituants ou des groupes d' activation stabilisent l'intermédiaire cationique formé au cours de la substitution en donnant des électrons dans le système cyclique, soit par effet inductif ou des effets de résonance . Des exemples de cycles aromatiques activés sont le toluène , l' aniline et le phénol .
La densité électronique supplémentaire délivrée dans le cycle par le substituant n'est pas répartie uniformément sur tout le cycle mais est concentrée sur les atomes 2, 4 et 6, de sorte que les substituants activateurs sont également des directeurs ortho / para (voir ci-dessous).
D'autre part, les substituants désactivants déstabilisent le cation intermédiaire et diminuent ainsi la vitesse de réaction par des effets inductifs ou de résonance. Ils le font en retirant la densité électronique du cycle aromatique. La désactivation du système aromatique signifie que des conditions généralement plus dures sont nécessaires pour conduire la réaction à son terme. Un exemple de ceci est la nitration du toluène pendant la production de trinitrotoluène (TNT). Alors que la première nitration, sur le cycle toluène activé, peut se faire à température ambiante et avec de l'acide dilué, la seconde, sur le cycle nitrotoluène désactivé, nécessite déjà un chauffage prolongé et plus d'acide concentré, et la troisième, sur un cycle très fortement désactivé. dinitrotoluène, doit être fait dans de l'acide sulfurique concentré bouillant . Les groupes qui retirent des électrons par résonance diminuent la densité électronique en particulier aux positions 2, 4 et 6, laissant les positions 3 et 5 comme celles avec une réactivité comparativement plus élevée, de sorte que ces types de groupes sont des méta-directeurs (voir ci-dessous). Les halogènes sont électronégatifs, donc ils se désactivent par induction, mais ils ont des paires isolées, donc ce sont des donneurs de résonance et donc des directeurs ortho / para.
Directeurs ortho / para
Les groupes avec des paires d'électrons non partagées , comme le groupe amino de l' aniline , sont fortement activateurs et ortho / para -directeurs par résonance. De tels groupes d'activation donnent ces électrons non partagés au système pi , créant une charge négative sur les positions ortho et para. Ces positions sont donc les plus réactives vis-à-vis d'un électrophile pauvre en électrons. La densité électronique la plus élevée est située à la fois sur les positions ortho et para, bien que cette réactivité accrue puisse être compensée par un encombrement stérique entre le substituant et l'électrophile. Le résultat final de la substitution aromatique électrophile pourrait donc être difficile à prédire, et il n'est généralement établi qu'en faisant la réaction et en déterminant le rapport de substitution ortho par rapport à para.
En plus de la nature nucléophile accrue de l'anneau d'origine, lorsque l'électrophile attaque les positions ortho et para de l'aniline, l' atome d' azote peut donner la densité électronique au système pi (formant un ion iminium ), donnant quatre structures de résonance (par opposition à trois dans la réaction de base). Cela améliore sensiblement la stabilité de l'intermédiaire cationique.
Lorsque l'électrophile attaque la position méta , l'atome d'azote ne peut pas donner de densité électronique au système pi , donnant seulement trois contributeurs de résonance. Ce raisonnement est cohérent avec les faibles rendements de produit méta- substitué.
D'autres substituants, tels que les substituants alkyle et aryle , peuvent également donner une densité électronique au système pi ; cependant, comme ils n'ont pas de paire d'électrons non partagés disponibles, leur capacité à le faire est plutôt limitée. Ainsi, ils n'activent que faiblement l'anneau et ne défavorisent pas fortement la position méta .
L'ortho-métallation dirigée est un type spécial d'EAS avec des directeurs ortho spéciaux .
Directeurs Meta
Les groupes non halogènes avec des atomes qui sont plus électronégatifs que le carbone, comme un groupe acide carboxylique (-CO 2 H), retirent une densité électronique substantielle du système pi . Ces groupes sont des groupes fortement désactivants . De plus, comme le carbone substitué est déjà pauvre en électrons, toute structure ayant un contributeur de résonance dans laquelle il y a une charge positive sur le carbone portant le groupe attracteur d'électrons (c'est-à-dire, attaque ortho ou para ) est moins stable que les autres. Par conséquent, ces groupes attracteurs d'électrons sont méta- directeurs car c'est la position qui n'a pas autant de déstabilisation.
La réaction est également beaucoup plus lente ( vitesse de réaction relative de 6x10 -8 par rapport au benzène) car le cycle est moins nucléophile.
Réaction sur la pyridine
Comparé au benzène, le taux de substitution électrophile sur la pyridine est beaucoup plus lent, en raison de l'électronégativité plus élevée de l'atome d'azote. De plus, l'azote de la pyridine obtient facilement une charge positive soit par protonation (par nitration ou sulfonation ) soit par des acides de Lewis (tels que AlCl 3 ) utilisés pour catalyser la réaction. Cela rend la réaction encore plus lente en ayant des charges formelles adjacentes sur le carbone et l'azote ou 2 charges formelles sur un atome localisé. Faire une substitution électrophile directement dans la pyridine est presque impossible.
Pour faire la réaction, elles peuvent être faites par 2 réactions possibles, toutes deux indirectes.
Une manière possible de faire une substitution sur la pyridine est la substitution aromatique nucléophile. Même sans catalyseur, l'atome d'azote, étant électronégatif, peut contenir la charge négative par lui-même. Une autre façon est de faire une oxydation avant la substitution électrophile. Cela rend la pyridine N -oxyde , qui, en raison de l'atome d'oxygène négatif, rend la réaction plus rapide que la pyridine et même le benzène. L'oxyde peut alors être réduit en pyridine substituée.
Attaque Ipso
La fixation d'un groupe entrant à une position dans un composé aromatique portant déjà un groupe substituant (autre que l'hydrogène). Le groupe entrant peut déplacer ce groupe substituant mais peut également être lui-même expulsé ou migrer vers une autre position dans une étape ultérieure. Le terme « ipso -substitution» n'est pas utilisé, car il est synonyme de substitution. Un exemple classique est la réaction de l'acide salicylique avec un mélange d'acide nitrique et sulfurique pour former de l'acide picrique . La nitration de la position 2 entraîne la perte de CO 2 en tant que groupe partant. La désulfonation dans laquelle un groupe sulfonyle est substitué par un proton est un exemple courant. Voir aussi le réarrangement de Hayashi . Dans les aromatiques substitués par du silicium, le silicium réagit par substitution ipso .
Hétérocycles à cinq membres
Comparés au benzène, les furanes , les thiophènes et les pyrroles sont plus sensibles aux attaques électrophiles. Ces composés contiennent tous un atome avec une paire d'électrons non partagés ( oxygène , soufre ou azote ) en tant que membre du cycle aromatique, ce qui stabilise sensiblement l'intermédiaire cationique. Des exemples de substitutions électrophiles au pyrrole sont la réaction de Pictet – Spengler et la réaction de Bischler – Napieralski .
Substitution aromatique électrophile asymétrique
Les substitutions aromatiques électrophiles avec des électrophiles de carbone prochiraux ont été adaptées pour la synthèse asymétrique en passant à des catalyseurs acides de Lewis chiraux , en particulier dans les réactions de type Friedel – Crafts . Un premier exemple concerne l'ajout de chloral à des phénols catalysés par du chlorure d'aluminium modifié avec du (-) - menthol . Un composé glyoxylate a été ajouté à la N, N-diméthylaniline avec un ligand bisoxazoline chiral - système catalytique triflate de cuivre (II) également dans une hydroxyalkylation de Friedel – Crafts :
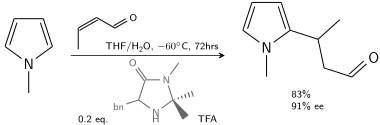
Dans une autre alkylation, le N-méthylpyrrole réagit avec le crotonaldéhyde catalysé par l'acide trifluoroacétique modifié par une imidazolidinone chirale :
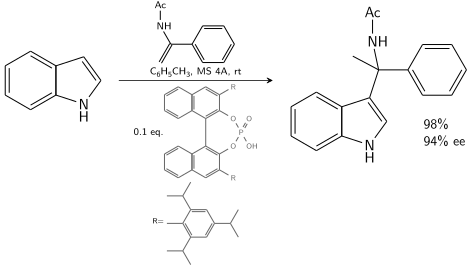
L'indole réagit avec un énamide catalysé par un acide phosphorique dérivé de BINOL chiral :
En présence de 10 à 20% de catalyseur chiral, 80 à 90% d' ee est réalisable.
Autres réactions
- D'autres réactions qui suivent un modèle de substitution aromatique électrophile sont un groupe de réactions de formylation aromatique comprenant la réaction de Vilsmeier – Haack , la réaction de Gattermann Koch et la réaction de Reimer – Tiemann .
- D'autres électrophiles sont les sels de diazonium aromatiques dans les couplages de diazonium , le dioxyde de carbone dans la réaction de Kolbe-Schmitt et les groupes carbonyle activés dans la condensation de Pechmann , l'ion hydroxycarbénium dans la chlorométhylation de Blanc via un intermédiaire (hydroxyméthyl) arène (alcool benzylique), le cation chloryle (ClO 3) + ) pour la perchlorylation électrophile .
- Dans la réaction de Lehmstedt – Tanasescu en plusieurs étapes , l'un des électrophiles est un intermédiaire N-nitroso.
- Dans la réaction Tscherniac – Einhorn (du nom de Joseph Tscherniac et Alfred Einhorn ), l'électrophile est un dérivé N-méthanol d'un amide