Marquage isotopique - Isotopic labeling
Le marquage isotopique (ou marquage isotopique ) est une technique utilisée pour suivre le passage d'un isotope (un atome avec une variation détectable du nombre de neutrons) à travers une réaction , une voie métabolique ou une cellule . Le réactif est "marqué" en remplaçant des atomes spécifiques par leur isotope. Le réactif est ensuite autorisé à subir la réaction. La position des isotopes dans les produits est mesurée pour déterminer la séquence suivie par l'atome isotopique dans la réaction ou la voie métabolique de la cellule. Les nucléides utilisés dans le marquage isotopique peuvent être des nucléides stables ou des radionucléides . Dans ce dernier cas, le marquage est appelé radiomarquage .
Dans le marquage isotopique, il existe plusieurs façons de détecter la présence d'isotopes de marquage ; par leur masse , leur mode vibrationnel ou leur décroissance radioactive . La spectrométrie de masse détecte la différence de masse d'un isotope, tandis que la spectroscopie infrarouge détecte la différence de modes vibrationnels de l'isotope. La résonance magnétique nucléaire détecte les atomes avec différents rapports gyromagnétiques. La décroissance radioactive peut être détectée à travers une chambre d'ionisation ou des autoradiographies de gels.
Un exemple d'utilisation du marquage isotopique est l'étude du phénol (C 6 H 5 OH) dans l'eau en remplaçant l' hydrogène commun ( protium ) par du deutérium ( marquage au deutérium ). Lors de l'ajout de phénol à de l' eau deutérée (eau contenant du D 2 O en plus du H 2 O habituel ), la substitution du deutérium à l'hydrogène est observée dans le groupe hydroxyle du phénol (donnant lieu à C 6 H 5 OD), indiquant que le phénol subit facilement réactions d'échange d'hydrogène avec l'eau. Seul le groupe hydroxyle est affecté, indiquant que les 5 autres atomes d'hydrogène ne participent pas aux réactions d'échange.
Traceur isotopique

Un traceur isotopique , (également « marqueur isotopique » ou « marqueur isotopique »), est utilisé en chimie et en biochimie pour aider à comprendre les réactions et interactions chimiques . Dans cette technique, un ou plusieurs des atomes de la molécule d'intérêt sont substitués à un atome du même élément chimique , mais d'un isotope différent (comme un isotope radioactif utilisé en radiotracing ). Parce que l'atome marqué a le même nombre de protons, il se comportera presque exactement de la même manière que son homologue non marqué et, à quelques exceptions près, n'interférera pas avec la réaction étudiée. La différence dans le nombre de neutrons , cependant, signifie qu'il peut être détecté séparément des autres atomes du même élément.
La résonance magnétique nucléaire (RMN) et la spectrométrie de masse (MS) sont utilisées pour étudier les mécanismes des réactions chimiques. La RMN et la SM détectent les différences isotopiques, ce qui permet de déterminer les informations sur la position des atomes marqués dans la structure des produits. Avec des informations sur le positionnement des atomes isotopiques dans les produits, la voie de réaction que les métabolites initiaux utilisent pour se convertir en produits peut être déterminée. Les isotopes radioactifs peuvent être testés à l'aide d' autoradiographies de gels en électrophorèse sur gel . Le rayonnement émis par les composés contenant les isotopes radioactifs assombrit un morceau de film photographique , enregistrant la position des composés marqués les uns par rapport aux autres dans le gel.
Les traceurs isotopiques sont couramment utilisés sous la forme de rapports isotopiques. En étudiant le rapport entre deux isotopes d'un même élément, nous évitons les effets impliquant l'abondance globale de l'élément, qui submergent généralement les variations beaucoup plus faibles des abondances isotopiques. Les traceurs isotopiques sont parmi les outils les plus importants en géologie car ils peuvent être utilisés pour comprendre les processus de mélange complexes dans les systèmes terrestres. Une discussion plus approfondie sur l'application des traceurs isotopiques en géologie est couverte sous le titre de la géochimie isotopique .
Les traceurs isotopiques sont généralement subdivisés en deux catégories : les traceurs isotopiques stables et les traceurs isotopiques radiogéniques . Les traceurs d'isotopes stables n'impliquent que des isotopes non radiogéniques et sont généralement dépendants de la masse. En théorie, tout élément avec deux isotopes stables peut être utilisé comme traceur isotopique. Cependant, les traceurs d'isotopes stables les plus couramment utilisés impliquent des isotopes relativement légers, qui subissent facilement un fractionnement dans les systèmes naturels. Voir aussi signature isotopique . Un traceur isotopique radiogénique implique un isotope produit par désintégration radioactive , qui est généralement en rapport avec un isotope non radiogène (dont l'abondance dans la terre ne varie pas en raison de la désintégration radioactive).
Étiquetage des isotopes stables
Le marquage des isotopes stables implique l'utilisation d' isotopes non radioactifs qui peuvent agir comme des traceurs utilisés pour modéliser plusieurs systèmes chimiques et biochimiques. L'isotope choisi peut agir comme un marqueur sur ce composé qui peut être identifié par résonance magnétique nucléaire (RMN) et spectrométrie de masse (MS). Certains des isotopes stables les plus courants sont le 2 H, le 13 C et le 15 N, qui peuvent ensuite être produits dans des solvants RMN , des acides aminés , des acides nucléiques , des lipides , des métabolites courants et des milieux de croissance cellulaire . Les composés produits en utilisant des isotopes de l' stables sont spécifiés par le pourcentage d'isotopes marqués (soit 30% uniformément marqué 13 glucose C contient un mélange qui est de 30% marqué avec 13 isotopes de carbone et 70% de carbone naturellement marqué) ou par les positions de carbone spécifiquement marquées sur le composé ( par exemple 1- 13 glucose de C , qui est marqué dans la première position de carbone du glucose).
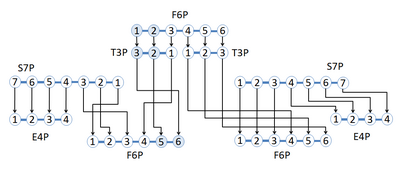
Un réseau de réactions adopté à partir de la voie de la glycolyse et de la voie des pentoses phosphates est montré dans lequel l'isotope de carbone marqué se réarrange en différentes positions de carbone tout au long du réseau de réactions. Le réseau commence avec le fructose 6-phosphate (F6P), qui a 6 atomes de carbone avec une étiquette 13 C en position carbone 1 et 2. 1,2- 13 C F6P devient deux glycéraldéhyde 3-phosphate (G3P), un 2,3 - 13 C T3P et un T3P non étiqueté. Le 2,3- 13 C T3P peut alors être mis à réagir avec sédoheptulose 7-phosphate (S7P) pour former un non marqué érythrose 4-phosphate (E4P) et un 5,6- 13 C F6P. Le T3P non marqué réagira avec le S7P pour synthétiser des produits non marqués. La figure montre l'utilisation du marquage isotopique stable pour découvrir le réarrangement des atomes de carbone par le biais de réactions utilisant des composés marqués spécifiques à la position.
Analyse des flux métaboliques par marquage aux isotopes stables

L'analyse des flux métaboliques (AMF) utilisant le marquage des isotopes stables est un outil important pour expliquer le flux de certains éléments à travers les voies métaboliques et les réactions au sein d'une cellule . Un marqueur isotopique est introduit dans la cellule, puis la cellule est autorisée à se développer en utilisant l'aliment marqué. Pour l'analyse du flux métabolique stationnaire, la cellule doit atteindre un état stable (les isotopes entrant et sortant de la cellule restent constants avec le temps) ou un état quasi-stationnaire (l'état stable est atteint pendant une période de temps donnée). Le profil isotopique du métabolite de sortie est déterminé. Le schéma isotopique de sortie fournit des informations précieuses, qui peuvent être utilisées pour trouver l'amplitude du flux , le taux de conversion des réactifs en produits , à travers chaque réaction.
La figure montre la possibilité d'utiliser différents marqueurs pour déterminer le flux à travers une certaine réaction. Supposons que le métabolite d'origine, un composé à trois carbones, a la capacité de se diviser en un métabolite à deux carbones et un métabolite à carbone dans une réaction puis se recombiner ou rester un métabolite à trois carbones. Si la réaction est fournie avec deux isotopes du métabolite en proportion égale, l'un complètement marqué (cercles bleus), communément appelé uniformément marqué, et l'autre complètement non marqué (cercles blancs). La voie en bas du côté gauche du diagramme n'affiche aucun changement dans les métabolites, tandis que le côté droit montre la division et la recombinaison. Comme indiqué, si le métabolite emprunte uniquement la voie du côté gauche, il reste dans un rapport de 50 à 50 entre le métabolite uniformément marqué et le métabolite non marqué. Si le métabolite ne prend que le bon côté, de nouveaux schémas d'étiquetage peuvent se produire, tous dans des proportions égales. D'autres proportions peuvent se produire en fonction de la quantité de métabolite d'origine qui suit le côté gauche de la voie par rapport au côté droit de la voie. Ici, les proportions sont indiquées pour une situation dans laquelle la moitié des métabolites prennent le côté gauche et la moitié du côté droit, mais d'autres proportions peuvent se produire. Ces motifs d'atomes marqués et d'atomes non marqués dans un composé représentent des isotopomères . En mesurant la distribution des isotopomères des métabolites marqués différemment, le flux à travers chaque réaction peut être déterminé.
La MFA combine les données récoltées à partir du marquage isotopique avec la stoechiométrie de chaque réaction, les contraintes et une procédure d'optimisation résolvent une carte de flux. Les réactions ir réversibles fournissent les contraintes thermodynamiques nécessaires pour trouver les flux. Une matrice est construite qui contient la stoechiométrie des réactions. Les flux intracellulaires sont estimés en utilisant une méthode itérative dans laquelle les flux simulés sont branchés sur le modèle stoechiométrique. Les flux simulés sont affichés dans une carte de flux, qui montre le taux de réactifs convertis en produits pour chaque réaction. Dans la plupart des cartes de flux, plus la flèche est épaisse, plus la valeur de flux de la réaction est grande.
Techniques de mesure du marquage isotopique
Toute technique de mesure de la différence entre les isotopomères peut être utilisée. Les deux méthodes principales, la résonance magnétique nucléaire (RMN) et la spectrométrie de masse (MS), ont été développées pour mesurer les isotopomères de masse dans le marquage des isotopes stables.
La RMN du proton a été la première technique utilisée pour 13 expériences C-étiquetage. En utilisant cette méthode, chaque position de carbone protoné à l'intérieur d'un pool de métabolites particulier peut être observée séparément des autres positions. Cela permet de connaître le pourcentage d'isotopomères marqués à cette position spécifique. La limite de la RMN du proton est que s'il y a n atomes de carbone dans un métabolite, il ne peut y avoir qu'au plus n valeurs d'enrichissement positionnelles différentes, ce qui ne représente qu'une petite fraction de l'information totale sur les isotopomères. Bien que l'utilisation du marquage RMN du proton soit limitée, les expériences de RMN du proton pur sont beaucoup plus faciles à évaluer que les expériences avec plus d'informations sur les isotopomères.
En plus de la RMN du proton , l'utilisation des techniques de RMN du 13 C permettra une vue plus détaillée de la distribution des isotopomères. Un atome de carbone marqué produira différents signaux de division hyperfine en fonction de l'état de marquage de ses voisins directs dans la molécule. Un pic singulet apparaît si les atomes de carbone voisins ne sont pas marqués. Un pic doublet apparaît si un seul atome de carbone voisin est marqué. La taille de la division du doublet dépend du groupe fonctionnel de l'atome de carbone voisin. Si deux atomes de carbone voisins sont marqués, un doublet de doublets peut dégénérer en triplet si les divisions de doublet sont égales.
Les inconvénients de l'utilisation des techniques de RMN à des fins d' analyse des flux métaboliques sont qu'elles sont différentes des autres applications de RMN car il s'agit d'une discipline plutôt spécialisée. Un spectromètre RMN peut ne pas être directement disponible pour toutes les équipes de recherche. L'optimisation des paramètres de mesure RMN et l'analyse appropriée des structures de pic nécessitent un spécialiste RMN qualifié. Certains métabolites peuvent également nécessiter des procédures de mesure spécialisées pour obtenir des données supplémentaires sur les isotopomères. De plus, des outils logiciels spécialement adaptés sont nécessaires pour déterminer la quantité précise de zones de pic ainsi que pour identifier la décomposition des pics singulet, doublet et triplet enchevêtrés.
Contrairement à la résonance magnétique nucléaire, la spectrométrie de masse (MS) est une autre méthode plus applicable et plus sensible aux expériences d'analyse de flux métabolique. Les instruments MS sont disponibles en différentes variantes. Différent de la résonance magnétique nucléaire bidimensionnelle ( 2D-RMN ), les instruments MS fonctionnent directement avec l' hydrolysat .
En chromatographie en phase gazeuse-spectrométrie de masse ( GC-MS ), la MS est couplée à un chromatographe en phase gazeuse pour séparer les composés de l'hydrolysat. Les composés élués de la colonne GC sont ensuite ionisés et simultanément fragmentés. L'avantage de l'utilisation de la GC-MS est que non seulement les isotopomères de masse de l'ion moléculaire sont mesurés, mais également le spectre d'isotopomères de masse de plusieurs fragments, ce qui augmente considérablement l'information mesurée.
En chromatographie liquide-spectrométrie de masse ( LC-MS ), le GC est remplacé par un chromatographe en phase liquide. La principale différence est que la dérivatisation chimique n'est pas nécessaire. Les applications de LC-MS à MFA, cependant, sont rares.
Dans chaque cas, les instruments MS divisent une distribution d'isotopomères particulière par son poids moléculaire. Tous les isotopomères d'un métabolite particulier qui contiennent le même nombre d'atomes de carbone marqués sont collectés dans un signal de pic. Étant donné que chaque isotopomère contribue à exactement un pic dans le spectre MS, la valeur en pourcentage peut ensuite être calculée pour chaque pic, ce qui donne la fraction massique d'isotopomères. Pour un métabolite à n atomes de carbone, n+1 mesures sont réalisées. Après normalisation, il reste exactement n quantités informatives d'isotopomères de masse.
L'inconvénient de l'utilisation des techniques MS est que pour la chromatographie en phase gazeuse, l'échantillon doit être préparé par dérivatisation chimique afin d'obtenir des molécules chargées. Il existe de nombreux composés utilisés pour dérivatiser des échantillons. Le N,N-Diméthylformamide diméthylacétal (DMFDMA) et le N-(tert-butyldiméthylsilyl)-N-méthyltrifluoroacétamide (MTBSTFA) sont deux exemples de composés qui ont été utilisés pour dérivatiser des acides aminés.
De plus, de forts effets isotopiques observés affectent le temps de rétention des isotopomères marqués différemment dans la colonne GC. La surcharge de la colonne GC doit également être évitée.
Enfin, l'abondance naturelle d'atomes autres que le carbone conduit également à une perturbation du spectre des isotopomères de masse. Par exemple, chaque atome d'oxygène dans la molécule peut également être présent en tant qu'isotope 17 O et en tant qu'isotope 18 O. Un impact plus significatif de l'abondance naturelle des isotopes est l'effet du silicium avec une abondance naturelle des isotopes 29 Si et 30 Si. Si est utilisé dans les agents de dérivation pour les techniques MS.
Applications dans la recherche en nutrition minérale humaine
L'utilisation de traceurs isotopiques stables pour étudier la nutrition et le métabolisme des minéraux chez l'homme a été signalée pour la première fois dans les années 1960. Alors que les radio-isotopes étaient utilisés dans la recherche en nutrition humaine depuis plusieurs décennies, les isotopes stables représentaient une option plus sûre, en particulier chez les sujets pour lesquels l'exposition aux rayonnements est très préoccupante, par exemple les femmes enceintes et allaitantes et les enfants. D'autres avantages offerts par les isotopes stables incluent la capacité d'étudier des éléments n'ayant pas de radio-isotopes appropriés et d'étudier le comportement des traceurs à long terme. Ainsi, l'utilisation d'isotopes stables est devenue courante avec la disponibilité croissante de matériaux enrichis en isotopes et de spectromètres de masse inorganiques. L'utilisation d'isotopes stables au lieu de radio-isotopes présente plusieurs inconvénients : de plus grandes quantités de traceur sont nécessaires, ayant le potentiel de perturber le minéral existant naturellement ; la préparation des échantillons analytiques est plus complexe et l' instrumentation de spectrométrie de masse plus coûteuse ; la présence de traceur dans des corps entiers ou des tissus particuliers ne peut pas être mesurée extérieurement. Néanmoins, les avantages ont prévalu, faisant des isotopes stables la norme dans les études humaines.
La plupart des minéraux essentiels à la santé humaine et particulièrement intéressants pour les chercheurs en nutrition possèdent des isotopes stables, dont certains conviennent bien comme traceurs biologiques en raison de leur faible abondance naturelle. Le fer , le zinc , le calcium , le cuivre , le magnésium , le sélénium et le molybdène sont parmi les minéraux essentiels ayant des isotopes stables auxquels des méthodes de traceurs isotopiques ont été appliquées. Le fer, le zinc et le calcium en particulier ont été largement étudiés.
Les aspects de la nutrition minérale/du métabolisme qui sont étudiés comprennent l'absorption (du tractus gastro-intestinal dans le corps), la distribution, le stockage, l'excrétion et la cinétique de ces processus. Les traceurs isotopiques sont administrés aux sujets par voie orale (avec ou sans nourriture, ou avec un supplément minéral) et/ou par voie intraveineuse. L'enrichissement isotopique est ensuite mesuré dans le plasma sanguin, les érythrocytes, l'urine et/ou les fèces. L'enrichissement a également été mesuré dans le lait maternel et le contenu intestinal. La conception de l'expérience du traceur diffère parfois entre les minéraux en raison de différences dans leur métabolisme. Par exemple, l'absorption du fer est généralement déterminée à partir de l'incorporation du traceur dans les érythrocytes, tandis que l'absorption du zinc ou du calcium est mesurée à partir de l'apparence du traceur dans le plasma, l'urine ou les fèces. L'administration de plusieurs traceurs isotopiques dans une même étude est courante, ce qui permet l'utilisation de méthodes de mesure plus fiables et des enquêtes simultanées sur de multiples aspects du métabolisme.
La mesure de l'absorption minérale de l'alimentation, souvent considérée comme la biodisponibilité , est l'application la plus courante des méthodes de traceurs isotopiques à la recherche en nutrition. Parmi les objectifs de ces études figurent les enquêtes sur la façon dont l'absorption est influencée par le type d'aliment (par exemple, source végétale contre source animale, lait maternel contre formule), d'autres composants de l'alimentation (par exemple, les phytates ), les maladies et les troubles métaboliques (par exemple , le dysfonctionnement entérique environnemental ), le cycle de reproduction, la quantité de minéraux dans l'alimentation, la carence minérale chronique , l'âge du sujet et les mécanismes homéostatiques. Lorsque les résultats de telles études sont disponibles pour un minéral, ils peuvent servir de base à des estimations des besoins physiologiques et alimentaires humains du minéral.
Lorsque le traceur est administré avec de la nourriture dans le but d'observer l'absorption et le métabolisme des minéraux, il peut se présenter sous la forme d'un marqueur intrinsèque ou extrinsèque. Un étiquetage intrinsèque est un isotope qui a été introduit dans l'aliment au cours de sa production, enrichissant ainsi la teneur minérale naturelle de l'aliment, tandis que l'étiquetage extrinsèque fait référence à l'ajout d'un isotope traceur à l'aliment au cours de l'étude. Parce qu'il s'agit d'une approche très longue et coûteuse, l'étiquetage intrinsèque n'est pas systématiquement utilisé. Des études comparant les mesures d'absorption utilisant l'étiquetage intrinsèque et extrinsèque de divers aliments ont généralement démontré une bonne concordance entre les deux méthodes d'étiquetage, soutenant l'hypothèse que les minéraux extrinsèques et naturels sont traités de la même manière dans le tractus gastro-intestinal humain.
L'enrichissement est quantifié à partir de la mesure des rapports isotopiques , le rapport de l'isotope traceur à un isotope de référence, par spectrométrie de masse. De multiples définitions et calculs d'enrichissement ont été adoptés par différents chercheurs. Les calculs d'enrichissement deviennent plus complexes lorsque plusieurs traceurs sont utilisés simultanément. Parce que les préparations isotopiques enrichies ne sont jamais isotopiquement pures, c'est-à-dire qu'elles contiennent tous les isotopes de l'élément en abondance non naturelle, les calculs d'enrichissement de plusieurs traceurs isotopiques doivent tenir compte de la perturbation de chaque rapport isotopique par la présence des autres traceurs.
En raison de la prévalence des carences minérales et de leur impact critique sur la santé et le bien-être humains dans les pays pauvres en ressources, l' Agence internationale de l'énergie atomique a récemment publié des descriptions détaillées et complètes des méthodes des isotopes stables pour faciliter la diffusion de ces connaissances aux chercheurs au-delà centres universitaires occidentaux.
Marquage radio-isotopique
Le marquage radio-isotopique est une technique permettant de suivre le passage d'un échantillon de substance à travers un système. La substance est "marquée" en incluant des radionucléides dans sa composition chimique. Lorsque ceux-ci se désintègrent , leur présence peut être déterminée en détectant le rayonnement émis par eux. Le marquage radio-isotopique est un cas particulier de marquage isotopique.
À ces fins, un type de désintégration radioactive particulièrement utile est l'émission de positons . Lorsqu'un positon entre en collision avec un électron, il libère deux photons de haute énergie se déplaçant dans des directions diamétralement opposées. Si le positron est produit à l'intérieur d'un objet solide, il le fera probablement avant de parcourir plus d'un millimètre. Si ces deux photons peuvent être détectés, l'emplacement de l'événement de désintégration peut être déterminé très précisément.
Au sens strict, le marquage radio-isotopique ne comprend que les cas où la radioactivité est introduite artificiellement par les expérimentateurs, mais certains phénomènes naturels permettent de réaliser une analyse similaire. En particulier, la datation radiométrique utilise un principe étroitement lié.
Applications en protéomique
En protéomique , l'étude de l'ensemble complet des protéines exprimées par un génome , l'identification des biomarqueurs de maladies peut impliquer l'utilisation du marquage isotopique stable par les acides aminés en culture cellulaire (SILAC), qui fournit des formes marquées isotopiques d'acides aminés utilisées pour estimer les niveaux de protéines . Dans la protéine recombinante, les protéines manipulées sont produites en grande quantité et le marquage isotopique est un outil pour tester les protéines pertinentes. Auparavant, la méthode consistait à enrichir sélectivement les noyaux avec du 13 C ou du 15 N ou à en épuiser 1 H. Le recombinant serait exprimé dans E. coli avec un milieu contenant du chlorure d'ammonium 15 N comme source d'azote. Les résultants 15 N protéines marquées sont ensuite purifiés par affinité sur métal immobilisé et leur pourcentage estimé. Afin d'augmenter le rendement des protéines marquées et de réduire le coût des milieux marqués aux isotopes, une procédure alternative augmente principalement la masse cellulaire en utilisant des milieux non marqués avant de l'introduire dans une quantité minimale de milieux marqués. Une autre application du marquage isotopique serait la mesure de la synthèse d'ADN, c'est-à-dire la prolifération cellulaire in vitro . Utilise le marquage H 3 -thymidine pour comparer le schéma de synthèse (ou la séquence) dans les cellules.
Applications pour l'analyse des processus écosystémiques
Les traceurs isotopiques sont utilisés pour examiner les processus dans les systèmes naturels, en particulier les environnements terrestres et aquatiques. En pédologie, les traceurs 15 N sont largement utilisés pour étudier le cycle de l'azote, tandis que le 13 C et le 14 C, respectivement stables et radio-isotopes du carbone, sont utilisés pour étudier le renouvellement des composés organiques et la fixation du CO.
2par les autotrophes . Par exemple, Marsh et al. (2005) ont utilisé de l' urée à double marquage ( 15 N- et 14 C) pour démontrer l'utilisation du composé par les oxydants de l' ammoniac à la fois comme source d'énergie (oxydation de l'ammoniac) et comme source de carbone (fixation du carbone chimiotrophique). L'eau deutérée est également utilisée pour retracer le devenir et l'âge de l'eau dans un arbre ou dans un écosystème.
Applications pour l'océanographie
Les traceurs sont également largement utilisés en océanographie pour étudier un large éventail de processus. Les isotopes utilisés sont généralement d'origine naturelle avec des sources et des taux de formation et de désintégration bien établis. Cependant, les isotopes anthropiques peuvent également être utilisés avec un grand succès. Les chercheurs mesurent les rapports isotopiques à différents endroits et moments pour déduire des informations sur les processus physiques de l'océan.
Transport de particules
L'océan est un vaste réseau de transport de particules. Les isotopes du thorium peuvent aider les chercheurs à déchiffrer le mouvement vertical et horizontal de la matière. Le 234 Th a un taux de production constant et bien défini dans l'océan et une demi-vie de 24 jours. Il a été démontré que cet isotope naturel varie linéairement avec la profondeur. Par conséquent, tout changement dans ce modèle linéaire peut être attribué au transport du 234 Th sur les particules. Par exemple, de faibles rapports isotopiques dans les eaux de surface avec des valeurs très élevées à quelques mètres de profondeur indiqueraient un flux vertical vers le bas. De plus, l'isotope du thorium peut être tracé à une profondeur spécifique pour déchiffrer le transport latéral des particules.
Circulation
La circulation dans les systèmes locaux, tels que les baies, les estuaires et les eaux souterraines, peut être examinée avec des isotopes du radium. Le 223 Ra a une demi-vie de 11 jours et peut se produire naturellement à des endroits spécifiques dans les rivières et les sources d'eau souterraine. Le rapport isotopique du radium diminuera alors à mesure que l'eau de la rivière source entrera dans une baie ou un estuaire. En mesurant la quantité de 223 Ra à un certain nombre d'emplacements différents, un schéma de circulation peut être déchiffré. Ce même processus exact peut également être utilisé pour étudier le mouvement et l'évacuation des eaux souterraines.
Divers isotopes du plomb peuvent être utilisés pour étudier la circulation à l'échelle mondiale. Différents océans (c'est-à-dire l'Atlantique, le Pacifique, l'Inde, etc.) ont des signatures isotopiques différentes. Cela résulte des différences dans les rapports isotopiques des sédiments et des roches dans les différents océans. Étant donné que les différents isotopes du plomb ont des demi-vies de 50 à 200 ans, il n'y a pas assez de temps pour que les rapports isotopiques s'homogénéisent dans tout l'océan. Ainsi, une analyse précise des rapports isotopiques du Pb peut être utilisée pour étudier la circulation des différents océans.
Processus tectoniques et changement climatique
Les isotopes avec des demi-vies extrêmement longues et leurs produits de désintégration peuvent être utilisés pour étudier des processus de plusieurs millions d'années, tels que la tectonique et les changements climatiques extrêmes. Par exemple, dans la datation rubidium-strontium , le rapport isotopique du strontium ( 87 Sr/ 86 Sr) peut être analysé dans les carottes de glace pour examiner les changements au cours de la vie de la Terre. Des différences dans ce rapport au sein de la carotte de glace indiqueraient des modifications importantes de la géochimie de la Terre.
Les processus susmentionnés peuvent être mesurés à l'aide d'isotopes naturels. Néanmoins, les isotopes anthropiques sont également extrêmement utiles pour les mesures océanographiques. Les essais d'armes nucléaires ont libéré une pléthore d'isotopes rares dans les océans du monde. 3 H, 129 I et 137 Cs peuvent être trouvés dissous dans l'eau de mer, tandis que 241 Am et 238 Pu sont attachés aux particules. Les isotopes dissous dans l'eau sont particulièrement utiles pour étudier la circulation mondiale. Par exemple, des différences dans les rapports isotopiques latéraux au sein d'un océan peuvent indiquer de forts fronts d'eau ou des tourbillons. Inversement, les isotopes attachés aux particules peuvent être utilisés pour étudier le transport de masse dans les colonnes d'eau. Par exemple, des niveaux élevés d'Am ou de Pu peuvent indiquer un downwelling lorsqu'ils sont observés à de grandes profondeurs, ou un upwelling lorsqu'ils sont observés à la surface.
Méthodes de marquage isotopique
- Synthèse chimique
- Échange enzymatique
- Expression de protéines recombinantes dans des milieux marqués isotopiquement.
Voir également
- Utilisations des radionucléides
- La radioactivité en biologie
- Traceur radioactif
- Isotopomère
- Isotopologue
- Étiquetage isobare
- Dilution isotopique
- Spectroscopie infrarouge des carbonyles métalliques
- Localisation des protéines organelles par marquage par méthode isotopique
Les références
- ^ Blake, Michael E.; Bartlett, Kevin L.; Jones, Maitland (2003). "Am-Benzyne trop-Benzyne Conversion à travers un 1,2-Shift d'un groupe phényle". Journal de l'American Chemical Society . 125 (21) : 6485-6490. doi : 10.1021/ja0213672 . ISSN 0002-7863 . PMID 12785789 .
- ^ Dickin, AP, 2005. Géologie des isotopes radiogéniques , Cambridge University Press.
- ^ un b Kruger, Nicolas; Antje von Schaewen (2003). « La voie oxydative des pentoses phosphates : structure et organisation » (PDF) . Opinion actuelle en biologie végétale . 6 (3) : 236-246. doi : 10.1016/s1369-5266(03)00039-6 . PMID 12753973 . Archivé de l'original (PDF) le 15 avril 2012.
- ^ [1] Archivé le 4 avril 2012, à la Wayback Machine
- ^ Wiechert, Wolfgang (2001). "Analyse du flux métabolique 13C". Génie métabolique . 3 (3) : 195-206. doi : 10.1006/mben.2001.0187 . PMID 11461141 .
- ^ un b Lee, Sang Yup; Park, Jong Myoung et Kim, Tae Yong (2011). Chapitre quatre : Application de l'analyse des flux métaboliques en génie métabolique . Méthodes en enzymologie . 498 . p. 67-93. doi : 10.1016/B978-0-12-385120-8.00004-8 . ISBN 9780123851208. PMID 21601674 .CS1 maint : plusieurs noms : liste des auteurs ( lien )
- ^ Stephanopoulos, Grégoire; Aristos A. Aristidou (1998). "Chapitre 9: Méthodes pour la détermination expérimentale des flux métaboliques par marquage isotopique". Ingénierie métabolique : principes et méthodologies . San Diego : Presse académique. p. 356–404. ISBN 978-0-12-666260-3.
- ^ Stephanopoulos, Grégoire (1999). "Flux métaboliques et ingénierie métabolique". Génie métabolique . 1 (1) : 1–11. doi : 10.1006/mben.1998.0101 . PMID 10935750 .
- ^ Klamt, Steffen; Jorg Stelling, Martin Ginkel et Ernst Dieter Gilles (2003). "FluxAnalyzer : explorer la structure, les voies et les distributions de flux dans les réseaux métaboliques sur des cartes de flux interactives" . Bioinformatique . 19 (2) : 261-269. doi : 10.1093/bioinformatique/19.2.261 . PMID 12538248 .CS1 maint : plusieurs noms : liste des auteurs ( lien )
- ^ A b c d e f Wiechert, Wolfgang (2001). "Analyse du flux métabolique 13C". Génie métabolique . 3 (3) : 195-206. doi : 10.1006/mben.2001.0187 . PMID 11461141 .
- ^ de Graaf, AA (2000c). Utilisation du marquage 13C et de la spectroscopie RMN dans l'analyse des flux métaboliques. Dans RMN in Biotechnology : Theory and Applications (J.-N. Barbotin et J.-C. Portais, Eds.), Horizon Scientific Press.
- ^ Christensen, B., et Nielsen, J. (2000). Analyse du réseau métabolique de Penicillium chrysogenum à l'aide de glucose marqué au 13C. Biotechnologie. Bioeng. 68, 652.659.
- ^ un b Dauner, M., et Sauer, U. (2000). L'analyse GC-MS des acides aminés fournit rapidement des informations riches pour l'équilibrage des isotopomères. Biotechnologie. Programme. 16, 642-649.
- ^ Turnlund, Judith (1989). « L'utilisation d'isotopes stables dans la recherche en nutrition minérale ». Journal de la nutrition . 119 (1) : 7-14. doi : 10.1093/jn/119.1.7 . PMID 2643698 .
- ^ un b Woodhouse, Leslie; Abrams, Steven (2001). "Les progrès dans la méthodologie des isotopes stables". Dans Lowe, Nicola ; Jackson, Malcolm (éd.). Avancées des méthodes isotopiques pour l'analyse des éléments traces chez l'homme . Boca Raton, Floride : CRC Press. p. 1–22. ISBN 0-8493-8730-2. OCLC 44579072 .CS1 maint: date et année ( lien )
- ^ Patterson, Kristine; Veillon, Claude (2001). « Isotopes stables de minéraux comme traceurs métaboliques dans la recherche en nutrition humaine ». Biologie expérimentale et médecine . 226 (4) : 271-282. doi : 10.1177/153537020122600403 . PMID 11368418 . S2CID 41966154 .
- ^ un b Sandstrom, Brittmarie (1996). "Aperçu des méthodes isotopiques et du métabolisme des nutriments inorganiques". À Mellon, Fred ; Sandstrom, Brittmarie (éd.). Isotopes stables en nutrition humaine : métabolisme des nutriments inorganiques . Londres : Harcourt Brace. p. 3-9. ISBN 0-12-490540-4. OCLC 35224694 .CS1 maint: date et année ( lien )
- ^ van Dokkum, Wim; Fairweather-Tait, Susan; Hurrell, Richard; Sandström, Brittmarie (1996). "Techniques d'étude". À Mellon, Fred; Sandstrom, Brittmarie (éd.). Isotopes stables en nutrition humaine : métabolisme des nutriments inorganiques . Londres : Academic Press. p. 23–42. ISBN 0-12-490540-4.
- ^ Fairweather-Tait, Susan; Renard, Tom ; Harvey, L; Dainty, Jack (2001). « Méthodes d'analyse de l'absorption des éléments traces ». Dans Lowe, Nicola ; Jackson, Malcolm (éd.). Avancées des méthodes isotopiques pour l'analyse des éléments traces chez l'homme . Boca Raton, Floride : CRC Press. p. 59-80. ISBN 0-8493-8730-2.
- ^ Davidsson, Léna (2001). « Études sur les oligo-éléments chez les nourrissons et les femmes enceintes ou allaitantes ». Dans Lowe, Nicola ; Jackson, Malcolm (éd.). Avancées des méthodes isotopiques pour l'analyse des éléments traces chez l'homme . Boca Raton, Floride : CRC Press. p. 167-186. ISBN 0-8493-8730-2.
- ^ un b Davidsson, L. (Lena), 1957- (2012). Évaluation de la biodisponibilité du fer chez l'homme à l'aide de techniques d'isotopes stables du fer . Agence internationale de l'énergie atomique. Vienne : Agence internationale de l'énergie atomique. ISBN 978-92-0-126510-4. OCLC 819377220 .CS1 maint : plusieurs noms : liste des auteurs ( lien )
- ^ Krebs, Nancy; Miller, Leland; Naake, Vernon ; Lei, Sian ; Westcott, Jamie; Fennessey, Paul; Hambidge, Michael (1995). « L'utilisation de techniques d'isotopes stables pour évaluer le métabolisme du zinc ». Journal de biochimie nutritionnelle . 6 (6) : 292-301. doi : 10.1016/0955-2863(95)00043-Y .
- ^ ANREF : Apports nutritionnels de référence pour la vitamine A, la vitamine K, l'arsenic, le bore, le chrome, le cuivre, l'iode, le fer, le manganèse, le molybdène, le nickel, le silicium, le vanadium et le zinc : un rapport du Panel sur les micronutriments ... et le Comité permanent sur l'évaluation scientifique des apports nutritionnels de référence, Food and Nutrition Board, Institute of Medicine . Institut de médecine (États-Unis). Panel sur les micronutriments. Washington, DC : National Academy Press. 2001. ISBN 0-309-51199-2. OCLC 52777031 .CS1 maint: autres ( lien )
- ^ Autorité européenne de sécurité des aliments (2014). "Avis scientifique sur les valeurs nutritionnelles de référence pour le zinc" . Journal de l'EFSA . 12 (10) : 3844. doi : 10.2903/j.efsa.2014.3844 . ISSN 1831-4732 .
- ^ Fairweather-Tait, Susan; Renard, Tom (1996). « Étiquetage intrinsèque et extrinsèque des éléments nutritifs inorganiques dans les études alimentaires ». À Mellon, Fred; Sandstrom, Brittmarie (éd.). Isotopes stables en nutrition humaine : métabolisme des nutriments inorganiques . Londres : Academic Press. p. 15-21. ISBN 0-12-490540-4.
- ^ AIEA. (2018). Évaluation du métabolisme du zinc chez l'homme à l'aide de techniques d'isotopes stables du zinc . Vienne : AIEA. p. 34-36. ISBN 978-92-0-108418-7. OCLC 1108521498 .
- ^ a b AIEA. (2018). Évaluation du métabolisme du zinc chez l'homme à l'aide de techniques d'isotopes stables du zinc . Vienne : AIEA. p. 50-58. ISBN 978-92-0-108418-7. OCLC 1108521498 .
- ^ AIEA. (2018). Évaluation du métabolisme du zinc chez l'homme à l'aide de techniques d'isotopes stables du zinc . Vienne : AIEA. ISBN 978-92-0-108418-7. OCLC 1108521498 .
- ^ "Étiquetage d'isotopes stables avec des acides aminés dans la culture cellulaire." SILAC. Paydey Lab, sd Web. 23 novembre 2011.
- ^ Couchette, David.M. "Expression de protéines marquées isotopiquement stables à utiliser comme étalons internes pour la quantification par spectrométrie de masse de biomarqueurs de protéines cliniques." NIST, laboratoire de mesure des matériaux. Le National Institute of Standards and Technology (NIST) est une agence du département américain du Commerce, 30 mars 2009. Web. 19 novembre 2011.
- ^ Marley, Jonathan; Lu, Min; Bracken, Argile (2001). « Une méthode pour un marquage isotopique efficace et une protéine recombinante ». Journal de l'étiquetage biomoléculaire . 20 (1) : 71-75. doi : 10.1023/a:1011254402785 . PMID 11430757 . S2CID 7811948 .
- ^ Allemand, Jacques. "Le modèle de synthèse d'ADN dans les chromosomes des cellules sanguines humaines." Presse universitaire Rockefeller. 20.1 37-65. Imprimer.
- ^ Marsh, KL, GK Sims et RL Mulvaney. 2005. Disponibilité de l'urée pour les bactéries autotrophes oxydant l'ammoniac en relation avec le devenir de l'urée marquée au 14C et au 15N ajoutée au sol. Biol. Fert. Sol. 42:137-145.
- ^ James, Shelley A.; Meinzer, Frédéric C. ; Goldstein, Guillermo ; Woodruff, David; Jones, Timothée ; Restom, Thérèse ; Mejia, Monique ; Clearwater, Michael ; Campanello, Paula (2003-01-01). "Le transport axial et radial de l'eau et le stockage interne de l'eau dans les arbres de la canopée des forêts tropicales" . Oecologie . 134 (1) : 37-45. doi : 10.1007/s00442-002-1080-8 . ISSN 1432-1939 .
- ^ Evaristo, Jaivime; Kim, Minseok; Haren, Joost van ; Pangle, Luke A.; Harman, Ciaran J.; Troch, Peter A.; McDonnell, Jeffrey J. (2019). "Caractérisation des flux et de la distribution par âge de l'eau du sol, de l'eau des plantes et de la percolation profonde dans un écosystème tropical modèle" . Recherche sur les ressources en eau . 55 (4) : 3307-3327. doi : 10.1029/2018WR023265 . hdl : 10150/634013 . ISSN 1944-7973 .
- ^ Coppola, L.; Roy-Barman, M. ; et al. (2006). « Les isotopes du thorium comme traceurs de la dynamique des particules et de la circulation des eaux profondes dans le secteur indien de l'océan Austral (ANTARES IV) ». Chimie marine . 100 (3-4): 299-313. doi : 10.1016/j.marchem.2005.10.019 .
- ^ Hougham, Alabama; Moran, SB ; et al. (2008). « Les changements saisonniers dans les rejets d'eaux souterraines sous-marines vers les étangs salés côtiers estimés en utilisant le 226Ra et le 228Ra comme traceurs ». Chimie marine . 109 (3-4): 268-278. doi : 10.1016/j.marchem.2007.08.001 .
- ^ Swarzenski, PW; Reich, C.; et al. (2007). « Les isotopes Ra et Rn en tant que traceurs naturels de la décharge d'eaux souterraines sous-marines à Tampa Bay, en Floride ». Chimie marine . 104 (1–2) : 69–84. doi : 10.1016/j.marchem.2006.08.001 .
- ^ Hickey-Vargas, R.; Bizimis, M. ; Deschamps, A. (2008). « Début de la signature isotopique de l'océan Indien dans la plaque de la mer des Philippines : preuves des isotopes Hf et Pb des terranes du Crétacé inférieur ». Lettres des sciences de la Terre et des planètes . 268 (3-4): 255-267. Bibcode : 2008F & PSL.268..255H . doi : 10.1016/j.epsl.2008.01.003 .
- ^ un b Haley, BA; Franck, M. ; et al. (2008). « Record isotopique radiogénique de la circulation de l'océan Arctique et des apports météorologiques des 15 derniers millions d'années ». Paléocéanographie . 23 (1) : PA1S13. Bibcode : 2008PalOc..23.1S13H . doi : 10.1029/2007PA001486 .
- ^ Povinec, PP; Breier, R.; et al. (2011). "Traçage des masses d'eau par une approche multi-isotopes dans le sud de l'océan Indien". Lettres des sciences de la Terre et des planètes . 302 (1–2) : 14–26. Bibcode : 2011F & PSL.302 ... 14P . doi : 10.1016/j.epsl.2010.11.026 .
- ^ Lee, S.-H.; Povinec, PP ; et al. (2009). "Les radionucléides comme traceurs des fronts d'eau dans le sud de l'océan Indien - Résultats ANTARES IV". Journal d'océanographie . 65 (3) : 397-406. doi : 10.1007/s10872-009-0035-7 . S2CID 131348352 .
Liens externes
|
Ressources de la bibliothèque sur l' étiquetage isotopique |