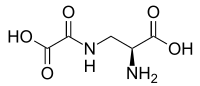
Acide oxalyldiaminopropionique - Oxalyldiaminopropionic acid
|
|
| Des noms | |
|---|---|
|
Nom IUPAC préféré
Acide (2 S )-2-amino-3-(oxaloamino)propanoïque |
|
| Autres noms | |
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| 3DMet | |
| Abréviations | |
| ChEBI | |
| ChemSpider | |
| KEGG | |
| Engrener | oxalyldiaminopropionique+acide |
|
CID PubChem
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 5 H 8 N 2 O 5 | |
| Masse molaire | 176,128 g·mol -1 |
| Composés apparentés | |
|
Composés apparentés
|
Bêta-Méthylamino-L-alanine |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
L' acide oxalyldiaminopropionique ( ODAP ) est un analogue structurel du neurotransmetteur glutamate présent dans la gesse Lathyrus sativus . C'est la neurotoxine responsable du lathyrisme du syndrome de dégénérescence des motoneurones .
Sources
L'ODAP se trouve dans les graines de la légumineuse L. sativus , une plante de gesse, à raison de 0,5 % p/p. L. sativus peut être trouvé dans des régions d'Europe méridionale, centrale et orientale, dans le bassin méditerranéen, en Irak et en Afghanistan ainsi que dans des régions d'Asie et d'Afrique.
Histoire
Dans certaines régions, dont le sous-continent indien, le Bangladesh, l'Éthiopie et le Népal, la gesse est devenue un aliment de base. La plante a une grande tolérance aux conditions environnementales, ce qui en fait la seule source de nourriture disponible en période de famine ou de sécheresse. Suite à ces sécheresses de plusieurs mois, des épidémies de neurolathyrisme peuvent survenir. Le dernier exemple d'une telle épidémie (en 2013) était en Éthiopie lors de la sécheresse de 1995-1997 au cours de laquelle 2000 personnes sont devenues handicapées de façon permanente.
Effets biologiques
L'ODAP est un agoniste du récepteur ionotrope du glutamate AMPA . Il est connu pour provoquer un neurolathyrisme chez l'homme, une maladie dégénérative des motoneurones caractérisée par une dégénérescence des neurones du tractus pyramidal dans la moelle épinière et dans la zone du cortex contrôlant les jambes, entraînant une paralysie du bas du corps. Il n'y a pas une explication directe quant à la façon dont l'ODAP provoque le neurolathyrisme; cependant, il y a eu des preuves pour soutenir quelques effets biologiques. L'une des raisons pour lesquelles le mécanisme d'action n'est pas tout à fait clair peut être que, jusqu'à présent, aucun bon modèle animal pour l'effet de l'ODAP chez l'homme n'a été trouvé. Le LD 50 est également inconnu.
Excitotoxicité
L'ODAP active les récepteurs AMPA qui peuvent induire une excitotoxicité ou une surstimulation des récepteurs du glutamate. La libération de trop de glutamate, en une seule fois ou sur une période prolongée, entraînera une augmentation des niveaux de Ca2+
dans le cytoplasme. Depuis Ca2+
est l'ion de signalisation pour la libération de glutamate dans la synapse, cela peut entraîner une potentialisation du cycle de libération de glutamate et la propagation de dommages excitotoxiques aux neurones voisins. À l'intérieur du neurone, le Ca supplémentaire2+
quittera le cytoplasme et entrera dans les mitochondries ou le réticulum endoplasmique (RE), ce qui peut conduire à l'accumulation de protéines mal repliées ou dépliées dans le RE et finalement à la mort cellulaire dans les deux cas. En plus d'agir comme un agoniste, il existe des preuves pour montrer que l'ODAP est transporté dans la cellule par un antiporteur qui transporte simultanément le glutamate dans la synapse.
Stress oxydant
Le deuxième effet biologique de l'ODAP est le stress oxydatif . Les espèces réactives de l'oxygène (ROS) sont générées dans les mitochondries pendant le métabolisme, et le corps a mis en place des mécanismes pour neutraliser ces molécules avant qu'elles ne causent des dommages. Le stress oxydatif résulte d'une perturbation du fonctionnement normal de ces voies. Un antioxydant dans la voie de neutralisation est le glutathion (GSH), dont la synthèse nécessite les acides aminés soufrés méthionine et cystéine comme précurseurs. On pense que l'ODAP, probablement en raison de l'excitotoxicité induite, réduit l'apport de cystéine par l'intermédiaire de son antiporteur . Cela inhibe la synthèse de GSH, entraînant une augmentation de la production de ROS et des dommages mitochondriaux. Les motoneurones peuvent être les plus sensibles à l'empoisonnement à l'ODAP car ils présentent une plus grande dépendance vis-à-vis du précurseur du GSH, la méthionine. De plus, L. sativus , en tant qu'aliment, est déficient en acides aminés contenant du soufre, ce qui renforce les effets au niveau des récepteurs de l'ODAP sur la production de GSH lorsqu'il est ingéré.
La synthèse
Biosynthèse
Chez L. sativus, l' ODAP est synthétisé dans les jeunes plantules à partir du précurseur (β-isoxazolin-5-on-2-yl)-alanine, également connu sous le nom de BIA. Le BIA n'a pas été détecté dans les parties de plantes matures ou les graines en cours de maturation. La voie commence par la formation de BIA à partir d' O-acétyl-L-sérine (OAS) et d'isoxazoline-5-on. Une ouverture de cycle conduit à la formation de l' acide 2,3-L-diaminopropanoïque intermédiaire de courte durée (DAPRO) qui est ensuite oxalylisé par l'oxalyl- coenzyme A pour former l'ODAP.
Synthèse chimique
L'ODAP peut être synthétisé à partir d'acide L-α,β-diaminopropionique et d' oxalate de diméthyle à un pH de 4,5-5. L'oxyde cuivrique peut être utilisé pour protéger temporairement le groupe α-NH2 de l'acide L-α,β-diaminopropionique pendant la réaction.
Voir également
- β-Méthylamino- L- alanine , une toxine apparentée


