Dihydroxylation asymétrique Sharpless - Sharpless asymmetric dihydroxylation
| Dihydroxylation asymétrique Sharpless | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Nommé après | Karl Barry Sharpless | ||||||||||
| Type de réaction | Réaction d'addition | ||||||||||
| Réaction | |||||||||||
|
|||||||||||
| Identifiants | |||||||||||
| Portail de la chimie organique | dihydroxylation sans pointe | ||||||||||
| ID d'ontologie RSC | RXNO: 0000142 | ||||||||||
La dihydroxylation asymétrique Sharpless (également appelée bishydroxylation Sharpless ) est la réaction chimique d'un alcène avec du tétroxyde d'osmium en présence d'un ligand quinine chiral pour former un diol vicinal . La réaction a été appliquée à des alcènes de pratiquement toutes les substitutions, souvent des énantiosélectivités élevées sont réalisées. Les réactions de dihydroxylation asymétrique sont également hautement sélectives de site, fournissant des produits dérivés de la réaction de la double liaison la plus riche en électrons dans le substrat.
Il est de pratique courante d'effectuer cette réaction en utilisant une quantité catalytique de tétroxyde d' osmium, qui après réaction est régénéré avec reoxidants tels que le ferricyanure de potassium ou de N de N de -oxyde . Cela réduit considérablement la quantité de tétroxyde d'osmium hautement toxique et très coûteuse nécessaire. Ces quatre réactifs sont prémélangés disponibles dans le commerce (« AD-mix »). Le mélange contenant (DHQ) 2 -PHAL est appelé AD-mix-α, et le mélange contenant (DHQD) 2 -PHAL est appelé AD-mix-β.
Ces diols chiraux sont importants dans la synthèse organique . L'introduction de la chiralité dans les réactifs non chiraux par l'utilisation de catalyseurs chiraux est un concept important en synthèse organique . Cette réaction a été développée principalement par K. Barry Sharpless en s'appuyant sur la dihydroxylation racémique d' Upjohn déjà connue , pour laquelle il a reçu une part du prix Nobel de chimie en 2001 .
Contexte
La dihydroxylation d'alcène par le tétroxyde d'osmium est une méthode ancienne et extrêmement utile pour la fonctionnalisation d'oléfines. Cependant, étant donné que les réactifs osmium (VIII) comme le tétroxyde d'osmium (OsO 4 ) sont coûteux et extrêmement toxiques, il est devenu souhaitable de développer des variantes catalytiques de cette réaction. Certains oxydants terminaux stoechiométriques qui ont été utilisés dans ces réactions catalytiques comprennent le chlorate de potassium , le peroxyde d'hydrogène ( hydroxylation de Milas ), le N- oxyde de N- méthylmorpholine (NMO, dihydroxylation d'Upjohn ), l' hydroperoxyde de tert- butyle ( t BHP) et le ferricyanure de potassium (K 3 Fe (CN) 6 ). K. Barry Sharpless a été le premier à développer une dihydroxylation alcène énantiosélective générale et fiable , appelée Dihydroxylation asymétrique Sharpless (SAD). De faibles niveaux d'OsO 4 sont combinés avec un oxydant ferricyanure stoechiométrique en présence de ligands azotés chiraux pour créer un environnement asymétrique autour de l'oxydant.
Mécanisme de réaction
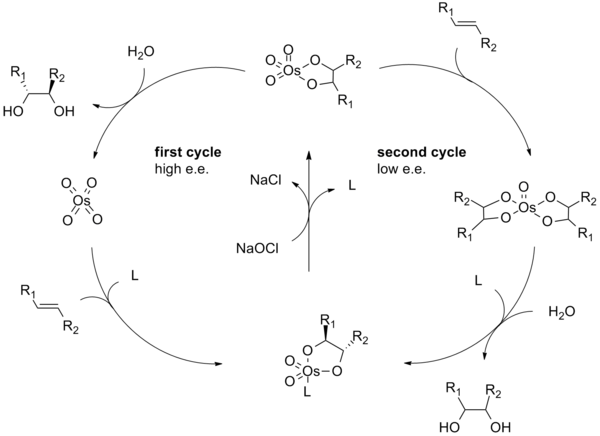
Le mécanisme de réaction de la dihydroxylation Sharpless commence par la formation du complexe tétroxyde d'osmium - ligand ( 2 ). Une cycloaddition [3 + 2] avec l'alcène ( 3 ) donne l'intermédiaire cyclique 4 . L' hydrolyse basique libère le diol ( 5 ) et l'osmate réduit ( 6 ). Le méthanesulfonamide (CH 3 SO 2 NH 2 ) a été identifié comme un catalyseur pour accélérer cette étape du cycle catalytique et s'il est fréquemment utilisé comme additif pour permettre aux substrats alcènes non terminaux de réagir efficacement à 0 ° C. Enfin, l' oxydant stoechiométrique régénère le complexe tétroxyde d'osmium - ligand ( 2 ).
Le mécanisme de la dihydroxylation asymétrique Sharpless a été largement étudié et un cycle catalytique secondaire potentiel a été identifié (voir ci-dessous). Si l'intermédiaire ester osmylate est oxydé avant de se dissocier, il se forme alors un complexe osmium (VIII) -diol qui peut alors dihydroxyler un autre alcène. Les dihydroxylations résultant de cette voie secondaire souffrent généralement d'énantiosélectivités inférieures à celles résultant de la voie primaire. Un schéma montrant cette voie catalytique secondaire est présenté ci-dessous. Cette voie secondaire peut être supprimée en utilisant une concentration molaire plus élevée de ligand.
Débat [2 + 2] contre [3 + 2]
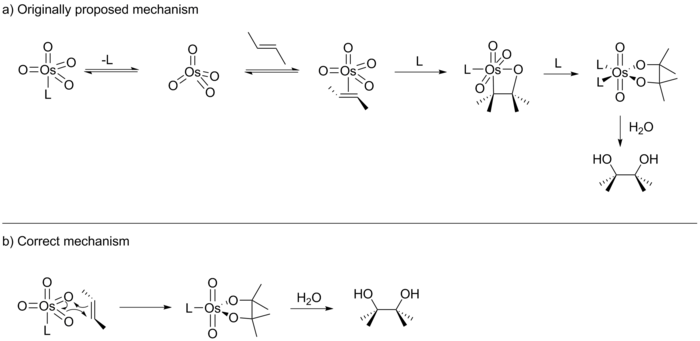
Dans son rapport original, Sharpless a suggéré que la réaction se déroule via une [2 + 2] cycloaddition d'OsO 4 sur l'alcène pour donner un intermédiaire osmaoxétane (voir ci-dessous). Cet intermédiaire subirait ensuite une insertion migratoire 1,1- pour former un ester osmylate qui, après hydrolyse, donnerait le diol correspondant. En 1989 EJ Corey a publié une variante légèrement différente de cette réaction et a suggéré que la réaction la plus probable par un procédé [3 + 2] cycloaddition de OsO 4 avec l'alcène pour générer directement l'ester osmylate. La suggestion de Corey était basée sur une étude informatique précédente réalisée par Jorgensen et Hoffman qui a déterminé que la voie de réaction [3 + 2] était la voie de la plus basse énergie. En outre, Corey a estimé que les répulsions stériques dans l'intermédiaire octaédrique défavoriseraient la voie [2 + 2].
Les dix années suivantes ont vu de nombreuses publications de Corey et Sharpless, chacun soutenant leur propre version du mécanisme. Bien que ces études n'aient pas été en mesure de faire la distinction entre les deux voies de cyclisation proposées, elles ont réussi à faire la lumière sur le mécanisme par d'autres moyens. Par exemple, Sharpless a fourni des preuves de la réaction se déroulant via un mécanisme par étapes. De plus, Sharpless et Corey ont montré que le catalyseur actif possède une poche de liaison chirale en forme de U. Corey a également montré que le catalyseur obéit à la cinétique de Michaelis-Menten et agit comme une poche enzymatique avec un pré-équilibre. Dans le numéro de février 1997 du Journal de l'American Chemical Society, Sharpless a publié les résultats d'une étude (une analyse de Hammett) qui, selon lui, soutenait une cyclisation [2 + 2] sur un [3 + 2]. Dans le numéro d'octobre de la même année, cependant, Sharpless a également publié les résultats d'une autre étude menée en collaboration avec Ken Houk et Singleton qui a fourni des preuves concluantes du mécanisme [3 + 2]. Ainsi Sharpless a été contraint de concéder le débat qui a duré une décennie.
Structure du catalyseur

Des preuves cristallographiques ont montré que le catalyseur actif possède une espèce d'osmium pentacoordonnée maintenue dans une poche de liaison en forme de U. Le ligand azoté retient OsO 4 dans un environnement chiral faisant approcher un côté de l'oléfine stériquement encombré tandis que l'autre ne l'est pas.
Systèmes catalytiques
De nombreux systèmes catalytiques et modifications ont été développés pour le SAD. Vous trouverez ci-dessous un bref aperçu des différents composants du système catalytique:
- Oxydant catalytique: Il s'agit toujours d'OsO 4 , cependant certains additifs peuvent se coordonner à l'osmium (VIII) et modifier ses propriétés électroniques. L'OsO 4 est souvent généré in situ à partir de K 2 OsO 2 (OH) 4 (une espèce d'Os (VI)) pour des raisons de sécurité.
- Auxiliaire chiral: Il s'agit généralement d'une sorte d'alcaloïde de quinquina.
- Oxydant stoechiométrique:
- Les peroxydes ont été parmi les premiers oxydants stoechiométriques à être utilisés dans ce cycle catalytique; voir l' hydroxylation de Milas . Les inconvénients des peroxydes comprennent des problèmes de chimiosélectivité.
- N-oxydes de trialkylammonium, tels que le NMO - comme dans la réaction d'Upjohn - et le N-oxyde de triméthylamine.
- Le ferricyanure de potassium (K 3 Fe (CN) 6 ) est l'oxydant stoechiométrique le plus couramment utilisé pour la réaction, et est l'oxydant qui entre dans les préparations AD-mix disponibles dans le commerce.
- Additif:
- Acide citrique: Le tétroxyde d'osmium est un oxydant électrophile et en tant que tel réagit lentement avec les oléfines déficientes en électrons. Il a été trouvé que la vitesse d'oxydation des oléfines déficientes en électrons peut être accélérée en maintenant le pH de la réaction légèrement acide. D'autre part, un pH élevé peut augmenter la vitesse d'oxydation des oléfines internes, et également augmenter l' excès énantiomérique (ee) pour l'oxydation des oléfines terminales.
Régiosélectivité
En général, la dihydroxylation asymétrique Sharpless favorise l'oxydation de l'alcène plus riche en électrons (schéma 1).
Dans cet exemple, SAD donne le diol de l'alcène le plus proche du groupe para-méthoxybenzoyle (attirant les électrons), bien qu'avec un faible rendement. Ceci est probablement dû à la capacité du cycle aryle à interagir favorablement avec le site actif du catalyseur via un empilement n. De cette manière, le substituant aryle peut agir comme un groupe directeur.
Stéréosélectivité
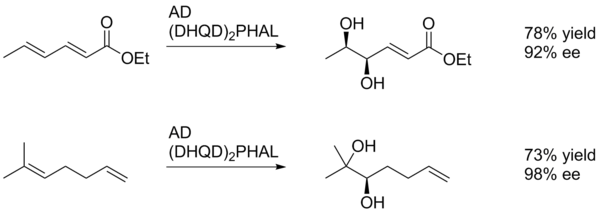
La diastéréosélectivité du SAD est déterminée principalement par le choix du ligand (c'est-à-dire AD-mix-α contre AD-mix-β), cependant des facteurs tels que la chiralité préexistante dans le substrat ou les groupes fonctionnels voisins peuvent également jouer un rôle. Dans l'exemple présenté ci-dessous, le substituant para-méthoxybenzoyle sert principalement de source de masse stérique pour permettre au catalyseur de différencier les deux faces de l'alcène.
Il est souvent difficile d'obtenir une diastéréosélectivité élevée sur les cis-alcènes lorsque les deux côtés de l'oléfine ont des environnements stériques similaires.
Lectures complémentaires
- Jacobsen, EN; Marko, I .; Mungall, WS; Schroeder, G .; Sharpless, KB (1988). "Dihydroxylation asymétrique par catalyse accélérée par ligand". Confiture. Chem. Soc. 110 (6): 1968-1970. doi : 10.1021 / ja00214a053 .
Voir également
- Oxydation catalytique asymétrique
- Hydroxylation de Milas
- Dihydroxylation d'Upjohn
- Aminohydroxylation sans rupture