Diéthyldithiocarbamate de sodium - Sodium diethyldithiocarbamate
|
|

|
|

|
|
| Des noms | |
|---|---|
|
Nom IUPAC préféré
Diéthylcarbamodithioate de sodium |
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChEMBL | |
| ChemSpider | |
| Carte Info ECHA |
100.005.192 |
|
PubChem CID
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 5 H 10 NS 2 Na | |
| Masse molaire | 171,259 g / mol (anhydre) |
| Apparence | Solide cristallin blanc, légèrement brun ou légèrement rose |
| Densité | 1,1 g / cm 3 |
| Point de fusion | 95 ° C (203 ° F; 368 K) |
| Soluble | |
| Solubilité | soluble dans l' alcool , l' acétone insoluble dans l' éther , le benzène |
| Dangers | |
| Principaux dangers | Nuisible |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Références Infobox | |
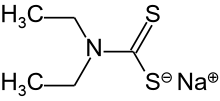
Le diéthyldithiocarbamate de sodium est le composé organosulfuré de formule NaS 2 CN (C 2 H 5 ) 2 . C'est un sel jaune pâle soluble dans l'eau.
Préparation
Ce sel est obtenu par traitement du disulfure de carbone par la diéthylamine en présence d' hydroxyde de sodium :
- CS 2 + HN (C 2 H 5 ) 2 + NaOH → NaS 2 CN (C 2 H 5 ) 2 + H 2 O
D'autres dithiocarbamates peuvent être préparés de manière similaire à partir d'amines secondaires et de disulfure de carbone. Ils sont utilisés comme agents chélatants pour les ions de métaux de transition et comme précurseurs d' herbicides et de réactifs de vulcanisation .
Oxydation en disulfure de thiurame
L'oxydation du diéthyldithiocarbamate de sodium donne le disulfure , également appelé disulfure de thiurame (Et = éthyle ):
- 2 NaS 2 CNEt 2 + I 2 → Et 2 NC (S) S-SC (S) NEt 2 + 2 NaI
Collage ligand

L'anion diéthyldithiocarbamate forme la base des complexes de dithiocarbamate de métal de transition . Les ligands se coordonnent à de nombreux métaux " plus mous " via les deux atomes de soufre. D'autres modes de liaison plus compliqués sont connus, y compris la liaison en tant que ligand non identifié et un ligand de pontage utilisant un ou les deux atomes de soufre.
Piégeage de spin des radicaux d'oxyde nitrique
Par la technique du spin trapping , les complexes de dithiocarbamates avec le fer constituent l'une des très rares méthodes pour étudier la formation de radicaux d' oxyde nitrique (NO) dans les matériaux biologiques. Bien que la durée de vie du NO dans les tissus soit trop courte pour permettre la détection de ce radical lui-même, le NO se lie facilement aux complexes fer-dithiocarbamate. Le complexe mono-nitrosyl-fer (MNIC) résultant est stable et peut être détecté par spectroscopie par résonance paramagnétique électronique (EPR).
Dans le cancer
La chélation du zinc du diéthyldithiocarbamate inhibe les métalloprotéinases , ce qui à son tour empêche la dégradation de la matrice extracellulaire , une étape initiale dans les métastases cancéreuses et l' angiogenèse .
Antioxydant
Le diéthyldithiocarbamate inhibe la superoxyde dismutase , qui peut à la fois avoir des effets antioxydants et oxydants sur les cellules, selon le moment de l'administration.
Les références
Lectures complémentaires
- Cvek B, Dvorak Z (2007). "Ciblage du facteur nucléaire-kappaB et protéasome par des complexes de dithiocarbamate avec des métaux" . Curr. Pharm. Des . 13 (30): 3155–67. doi : 10.2174 / 138161207782110390 . PMID 17979756 .
