trans -Cycloctène - trans-Cyclooctene
|
|
| Noms | |
|---|---|
|
Nom IUPAC préféré
( E )-Cycloctène |
|
| Autres noms
trans -cyclooctène
|
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| Numéro CE | |
|
CID PubChem
|
|
|
|
|
|
| Propriétés | |
| C 8 H 14 | |
| Masse molaire | 110.200 g·mol -1 |
| Apparence | liquide incolore |
| Densité | 0,848 g/ml |
| Point de fusion | −59 °C (−74 °F; 214 K) |
| Point d'ébullition | 143 °C (1 atmosphère); 68-72 °C (100 torrs) |
| Dangers | |
| Pictogrammes SGH |
 
|
| Mention d'avertissement SGH | Danger |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
| Références de l'infobox | |
Le trans- cyclooctène est un hydrocarbure cyclique de formule [–(CH 2 ) 6 CH=CH–], où les deux liaisons simples C–C adjacentes à la double liaison se trouvent sur les côtés opposés du plan de cette dernière. C'est un liquide incolore avec une odeur désagréable.
Cyclooctène est remarquable que le plus petit cycloalcène qui est facilement isolé comme trans - isomère . L' isomère cis est beaucoup plus stable ; les énergies de déformation annulaire étant respectivement de 16,7 et 7,4 kcal/mol.
 |
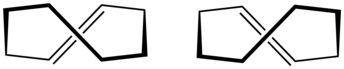
|
| cis -Cyclooctène | trans -cyclooctène |
Un arrangement planaire des carbones du cycle serait trop tendu et, par conséquent, les conformations stables de la forme trans ont un cycle courbé (non plan). Les calculs indiquent que la conformation "couronne" la plus stable a les atomes de carbone alternativement au-dessus et au-dessous du plan de l'anneau. Une conformation "demi-chaise", avec une énergie supérieure d'environ 6 kcal/mol, a des carbones 2,3,5,6 et 8 du même côté du plan des carbones 1,4 et 7.
Toutes les conformations du trans- cyclooctène sont chirales (en particulier, ce que certains appellent planar-chiral ) et les énantiomères peuvent être séparés. En théorie, la conversion entre les énantiomères peut se faire, sans rompre aucune liaison, en tordant l'ensemble du groupe –CH=CH–, de manière rigide, de 180 degrés. Cependant, cela implique de faire passer l'un de ses hydrogènes à travers l'anneau encombré.
Préparation
Le trans- cyclooctène a été synthétisé pour la première fois à une échelle préparatoire par Arthur C. Cope avec une réaction d' élimination de Hofmann de l' iodure de N,N,N- triméthylcyclooctylammonium. La réaction donne un mélange d' isomères cis et trans , et l' isomère trans est piégé sélectivement sous la forme d'un complexe avec du nitrate d'argent .
D'autres méthodes existent où l' isomère trans est synthétisé à partir de l' isomère cis en plusieurs étapes de synthèse. Par exemple, il peut être préparé avec un rendement de presque 100 % en convertissant l' isomère cis en 1,2-époxycyclooctane (« oxyde de cyclooctène ») suivi de réactions avec le diphénylphosphure de lithium ( LiPPh
2) et avec l'iodure de méthyle CH
3je . (Des procédures similaires peuvent donner des isomères cis , trans du 1,4-cyclooctadiène et du 1,5-cyclooctadiène ).
De plus, il existe une méthode photochimique pour l' isomérisation directe cis – trans . Bien que cet équilibre favorise fortement la forme cis plus stable , la réaction peut être dirigée vers la forme trans par piégeage avec des ions argent.
Réactions
En raison de la contrainte interne plus élevée sur la double liaison, l' isomère trans est plus réactif que l' isomère cis et des hydrocarbures insaturés typiques. Par exemple, sa double liaison ajoutera rapidement de la tétrazine et ses dérivés. Le composé polymérise également facilement avec un initiateur à base de ruthénium .
