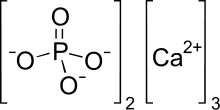
Phosphate tricalcique - Tricalcium phosphate
|
|
|
|
| Noms | |
|---|---|
|
Nom IUPAC
Bis(phosphate tricalcique)
|
|
| Autres noms
Phosphate de calcium tribasique
|
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| Carte d'information de l'ECHA |
100.028.946 |
|
CID PubChem
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| Ca 3 (PO 4 ) 2 | |
| Masse molaire | 310.18 |
| Apparence | Poudre amorphe blanche |
| Densité | 3,14 g / cm 3 |
| Point de fusion | 1 670 °C (3 040 °F; 1 940 K) |
| 1,2 mg/kg | |
|
Produit de solubilité ( K sp )
|
2,07 × 10 −33 |
| Thermochimie | |
|
Std enthalpie de
formation (Δ f H ⦵ 298 ) |
-4126 kJ/mol (forme α) |
| Pharmacologie | |
| A12AA01 ( OMS ) | |
| Dangers | |
| NFPA 704 (diamant de feu) | |
| point de rupture | Ininflammable |
| Composés apparentés | |
|
Autres anions
|
Pyrophosphate de calcium |
|
Autres cations
|
Phosphate trimagnésien Phosphate trisodique Phosphate tripotassique |
|
Composés apparentés
|
Phosphate monocalcique Phosphate dicalcique |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
Le phosphate tricalcique (parfois abrégé TCP ) est un sel de calcium de l'acide phosphorique de formule chimique Ca 3 (PO 4 ) 2 . Il est également connu sous le nom de phosphate de calcium tribasique et de phosphate de chaux osseux ( BPL ). C'est un solide blanc de faible solubilité. La plupart des échantillons commerciaux de « phosphate tricalcique » sont en fait de l' hydroxyapatite .
Il existe sous la forme de trois polymorphes cristallins α, α' et . Les états α et ' sont stables à haute température.
Nomenclature
Le phosphate de calcium désigne de nombreux matériaux constitués d'ions calcium (Ca 2+ ) ainsi que d' orthophosphates (PO 4 3− ), de métaphosphates ou de pyrophosphates (P 2 O 7 4− ) et occasionnellement d' ions oxyde et hydroxyde . En particulier, l' apatite minérale commune a la formule Ca 5 (PO 4 ) 3 X , où X est F , Cl , OH ou un mélange; il s'agit d' hydroxyapatite si l'ion supplémentaire est principalement de l'hydroxyde. Une grande partie du "phosphate tricalcique" sur le marché est en fait de l' hydroxyapatite en poudre .
Préparation
Le phosphate tricalcique est produit commercialement en traitant l' hydroxyapatite avec de l'acide phosphorique et de la chaux éteinte .
Il ne peut pas être précipité directement à partir d'une solution aqueuse. Typiquement, des réactions de double décomposition sont utilisées, impliquant un phosphate soluble et des sels de calcium, par exemple (NH 4 ) 2 HPO 4 + Ca(NO 3 ) 2 . est réalisée dans des conditions de pH soigneusement contrôlées. Le précipité sera soit du "phosphate tricalcique amorphe", ATCP, soit de l'hydroxyapatite déficiente en calcium, CDHA, Ca 9 (HPO 4 ) (PO 4 ) 5 (OH), (notez que le CDHA est parfois appelé triphosphate de calcium apatitique). Le phosphate tricalcique cristallin peut être obtenu par calcination du précipité. -Ca 3 (PO 4 ) 2 est généralement formé, des températures plus élevées sont nécessaires pour produire α-Ca 3 (PO 4 ) 2 .
Une alternative à la procédure humide consiste à chauffer un mélange d'un pyrophosphate de calcium et de carbonate de calcium :
- CaCO 3 + Ca 2 P 2 O 7 → Ca 3 (PO 4 ) 2 + CO 2
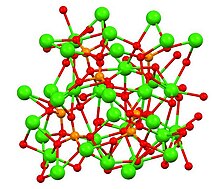
Structure des polymorphes β-, α- et '- Ca 3 (PO 4 ) 2
Le phosphate tricalcique a trois polymorphes reconnus, la forme - rhomboédrique (illustrée ci-dessus) et deux formes à haute température, α- monoclinique et '- hexagonale. Le phosphate -tricalcique a une densité cristallographique de 3,066 g cm -3 tandis que les formes à haute température sont moins denses, le phosphate α-tricalcique a une densité de 2,866 g cm -3 et le phosphate '-tricalcique a une densité de 2,702 g cm − 3 Toutes les formes ont des structures complexes constituées de centres phosphates tétraédriques liés par l'oxygène aux ions calcium. Les formes à haute température ont chacune deux types de colonnes, l'une contenant uniquement des ions calcium et l'autre à la fois du calcium et du phosphate.
Il existe des différences de propriétés chimiques et biologiques entre les formes bêta et alpha, la forme alpha est plus soluble et biodégradable. Les deux formes sont disponibles dans le commerce et sont présentes dans des formulations utilisées dans des applications médicales et dentaires.
Occurrence
Le phosphate de calcium est l'un des principaux produits de combustion des os (voir cendres d'os ). Le phosphate de calcium est également couramment dérivé de sources inorganiques telles que la roche minérale. Le phosphate tricalcique se présente naturellement sous plusieurs formes, notamment :
- sous forme de roche au Maroc , en Israël , aux Philippines , en Égypte et à Kola ( Russie ) et en plus petites quantités dans certains autres pays. La forme naturelle n'est pas complètement pure et d'autres composants comme le sable et la chaux peuvent modifier la composition. En termes de P 2 O 5 , la plupart des roches phosphatées de calcium ont une teneur de 30 à 40 % en poids de P 2 O 5 .
- dans les squelettes et les dents des animaux vertébrés
- dans le lait .
Phosphate tricalcique biphasique, BCP
Le phosphate tricalcique biphasique, BCP, a été signalé à l'origine sous le nom de phosphate tricalcique, mais les techniques de diffraction des rayons X ont montré que le matériau était un mélange intime de deux phases, l'hydroxyapatite (HA) et le phosphate β-tricalcique. C'est une céramique. La préparation implique le frittage provoquant la décomposition irréversible des apatites déficientes en calcium appelées alternativement apatites non stoechiométriques ou phosphate de calcium basique, un exemple est :
- Ca 10−δ (PO 4 ) 6−δ (HPO 4 ) δ (OH) 2−δ → (1-δ)Ca 10 (PO 4 ) 6 (OH) 2 + 3δCa 3 (PO 4 ) 2
Le β-TCP peut contenir des impuretés, par exemple du pyrophosphate de calcium, du CaP 2 O 7 et de l'apatite. Le β-TCP est biorésorbable. La biodégradation du BCP implique une dissolution plus rapide de la phase β-TCP suivie de l'élimination des cristaux de HA. Le β-TCP ne se dissout pas dans les fluides corporels à des niveaux de pH physiologiques, la dissolution nécessite une activité cellulaire produisant un pH acide.
Les usages
Additif alimentaire
Le phosphate tricalcique est utilisé dans les épices en poudre comme antiagglomérant , par exemple pour empêcher le sel de table de s'agglutiner. Les phosphates de calcium ont été assignés européenne additif alimentaire numéro E341 .
Produits de santé et de beauté
On le trouve également dans la poudre pour bébé , les antiacides et le dentifrice .
Biomédical
Il est également utilisé comme supplément nutritionnel et se trouve naturellement dans le lait de vache , bien que les formes les plus courantes et les plus économiques de supplémentation soient le carbonate de calcium (qui doit être pris avec de la nourriture) et le citrate de calcium (qui peut être pris sans nourriture). Il existe un débat sur les différentes biodisponibilités des différents sels de calcium.
Il peut être utilisé comme substitut tissulaire pour réparer les défauts osseux lorsque la greffe osseuse autogène n'est pas faisable ou possible. Il peut être utilisé seul ou en association avec un polymère biodégradable et résorbable tel que l' acide polyglycolique . Il peut également être associé à des matériaux autologues pour une greffe osseuse.
Des échafaudages poreux en phosphate bêta-tricalcique sont utilisés comme systèmes de support de médicament pour l'administration locale de médicament dans l'os.
Occurrence naturelle
Tuite , un analogue naturel de l'orthophosphate tricalcique (V), est un composant rare de certaines météorites. Sa formation est liée au métamorphisme de choc.
Les références

