Tétrafluoroborate de triméthyloxonium - Trimethyloxonium tetrafluoroborate
|
|

|
|
| Des noms | |
|---|---|
|
Nom IUPAC
Tétrafluoroborate de triméthyloxonium
|
|
| Autres noms
Sel de Meerwein fluoroborate de triméthyloxonium |
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChemSpider | |
| Carte Info ECHA |
100,006,360 |
|
PubChem CID
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 3 H 9 B F 4 O | |
| Masse molaire | 147,91 g · mol −1 |
| Point de fusion | 179,6 à 180 ° C (355,3 à 356,0 ° F; 452,8 à 453,1 K) |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|
| Références Infobox | |
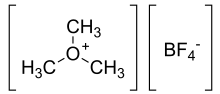
Le tétrafluoroborate de triméthyloxonium est le composé organique de formule (CH
3 )
3 OBF
4 . (Il est parfois appelé "sel de Meerwein" après Hans Meerwein .) Ce sel est un agent de méthylation puissant , étant un équivalent synthétique de CH +
3 . C'est un solide blanc qui se dégrade rapidement lors de l'exposition à l'humidité atmosphérique, bien qu'il soit suffisamment robuste pour être pesé et distribué rapidement sans l'avantage d'une protection contre l'atmosphère inerte. Le tétrafluoroborate de triéthyloxonium est un réactif étroitement apparenté.
Préparation et réactions
Le composé est préparé par réaction de trifluorure de bore avec de l'éther diméthylique et de l' épichlorhydrine :
- 4 moi
2 O · BF
3 + 2 moi
2 O + 3 C
2 H
3 (O) CH
2 Cl → 3 Moi
3 O + BF -
4 + B [(OCH (CH
2 Cl) CH
2 OMe]
3
Le sel s'hydrolyse facilement:
-
Moi
3 OBF
4 + H
2 O → moi
2 O + MeOH + HBF
4
Le tétrafluoroborate de triméthyloxonium est généralement classé comme le réactif le plus puissant disponible dans le commerce pour la méthylation électrophile , étant plus fort que les esters de sulfonate de méthyle, y compris le triflate de méthyle et le fluorosulfonate de méthyle ("méthyle magique"). Seuls les réactifs exotiques diméthylhalonium ( Me
2 X + SbF -
6 , X = Cl, Br, I), les réactifs de carboranate de méthyle et le cation méthyldiazonium généré de manière transitoire ( MeN +
2 ) sont des sources plus puissantes de méthyle électrophile.
En raison de sa réactivité élevée, il est rapidement détruit par l'humidité atmosphérique et il est préférable de le conserver dans une boîte à gants à atmosphère inerte à -20 ° C. Ses produits de dégradation sont corrosifs, bien qu'il soit considérablement moins dangereux que le triflate de méthyle ou le fluorosulfonate de méthyle, en raison de son manque de volatilité.
