Acide 2-iodoxybenzoïque - 2-Iodoxybenzoic acid

|
|||
|
|
|||
| Noms | |||
|---|---|---|---|
|
Nom IUPAC préféré
1-Hydroxy-1λ 5 ,2-benziodoxole-1,3-dione |
|||
| Autres noms
1-Hydroxy-1λ 3 ,2-benziodoxol-3(1 H )-one 1-oxyde
|
|||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Carte d'information de l'ECHA |
100.157.592 |
||
|
CID PubChem
|
|||
|
Tableau de bord CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriétés | |||
| C 7 H 5 IO 4 | |||
| Masse molaire | 280,02 g/mol | ||
| Point de fusion | 233 °C (se décompose) | ||
| Dangers | |||
| Phrases R (obsolètes) | R22 R34 R44 | ||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Références de l'infobox | |||
L'acide 2-iodoxybenzoïque ( IBX ) est un composé organique utilisé en synthèse organique comme agent oxydant . Ce periodinane est particulièrement adapté pour oxyder les alcools en aldéhydes . IBX est préparé à partir d' acide 2-iodobenzoïque , de bromate de potassium et d'acide sulfurique . Frigerio et ses collègues ont également démontré, en 1999 que le bromate de potassium peut être remplacé par Oxone disponible dans le commerce . L'un des principaux inconvénients d'IBX est sa solubilité limitée ; IBX est insoluble dans de nombreux solvants organiques courants. Dans le passé, on croyait que l'IBX était sensible aux chocs , mais il a été proposé plus tard que les échantillons d'IBX étaient sensibles aux chocs en raison du bromate de potassium résiduel laissé par sa préparation. L'IBX commercial est stabilisé par des acides carboxyliques tels que l'acide benzoïque et l'acide isophtalique .
Mécanisme de réaction
Le mécanisme de réaction pour une oxydation d'un alcool en un aldéhyde selon le mécanisme de torsion hypervalent implique une réaction d'échange de ligand remplaçant le groupe hydroxyle par l'alcool suivie d'une réaction de torsion et d' élimination . La torsion est une exigence car la double liaison iode-oxygène est orientée hors du plan avec le groupe alcoxy et l' élimination concertée ne pourrait pas avoir lieu. Cette réaction de torsion est un réarrangement dans lequel l'atome d'oxygène est déplacé dans un plan approprié pour un état de transition cyclique à 5 chaînons dans la réaction d'élimination et est calculé par la chimie informatique comme étant l' étape déterminante de la vitesse de l'oxydation. Le mécanisme de torsion explique également pourquoi l'oxydation est plus rapide pour les alcools plus gros que pour les petits alcools. La torsion est entraînée vers l'avant par l' encombrement stérique qui existe entre l' atome d'hydrogène ortho et les protons du groupe alcoxy et les groupes alcoxy plus grands créent une répulsion stérique plus importante. Le même calcul prédit un dérivé IBX à réaction beaucoup plus rapide avec une vitesse de réaction de 100 fois lorsque cet atome d'hydrogène ortho est remplacé par un groupe méthyle , facilitant ainsi la torsion jusqu'à ce que la réaction d'élimination prenne la prédominance comme étape déterminante de la vitesse.

IBX existe sous forme de deux tautomères dont l' un est l' acide carboxylique . L' acidité de l'IBX qui a été déterminée dans l'eau ( pKa 2,4) et le DMSO (pKa 6,65) est connue pour affecter les réactions organiques, par exemple l' isomérisation catalysée par un acide accompagnant les oxydations.
Portée
IBX est également disponible sous forme d' IBX lié au gel de silice ou au polystyrène . Dans de nombreuses applications, IBX est remplacé par le periodinane Dess-Martin qui est plus soluble dans les solvants organiques courants. Une réaction d'échantillon est une oxydation IBX utilisée dans la synthèse totale d' eicosanoïde : More et Finney et Van Arman ont démontré que les solvants organiques courants conviennent à de nombreuses oxydations IBX, malgré sa faible solubilité, et peuvent en fait simplifier la purification du produit.
-
 Données clés de l'oxydation de l' alcool en aldéhyde par IBX : a) IBX, DMSO , THF , 4h, rendement chimique de 94 % (Mohapatra, 2005)
Données clés de l'oxydation de l' alcool en aldéhyde par IBX : a) IBX, DMSO , THF , 4h, rendement chimique de 94 % (Mohapatra, 2005)
En 2001, KC Nicolaou et ses collègues ont publié une série d'articles dans le Journal of the American Chemical Society démontrant, entre autres transformations, l'utilisation d'IBX pour oxyder les carbones benzyliques primaires et secondaires en aldéhydes aromatiques et en cétones, respectivement.
Clivage oxydant
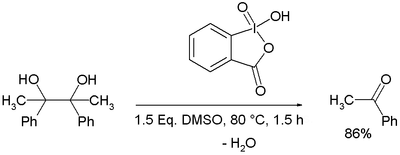
IBX est remarquable pour oxyder les diols vicinaux (ou glycols) en dicétones sans clivage de la liaison carbone-carbone, mais le clivage oxydatif des glycols en deux aldéhydes ou cétones peut se produire lorsque des conditions modifiées sont utilisées (températures élevées ou solvant acide trifluoroacétique).
Le mécanisme de réaction pour ce clivage du glycol est basé sur la formation initiale d'un adduit entre 10-I-4 IBX et DMSO à un 12-I-5 intermédiaire 3 dans lequel le DMSO agit comme un groupe partant pour l' alcool entrant 4 vers l'intermédiaire 5 . Un équivalent d'eau est séparé pour former 12-I-5 periodinane spirobicyclique 6, ouvrant la voie à la fragmentation à 7 . En présence de protons hydroxyles alpha, l'oxydation de l' acyloïne entre en compétition. L'acide trifluoroacétique s'avère faciliter la réaction globale.
-hydroxylations
Kirsch et ses collègues ont pu hydroxyler des composés céto avec IBX en position dans des conditions douces. Cette méthode pourrait être étendue aux -céto esters.
Oxydation des -hydroxycétones en β-dicétones
Bartlett et Beaudry ont découvert qu'IBX est un réactif précieux pour la transformation des -hydroxycétones en β-dicétones. IBX fournit des rendements supérieurs aux protocoles d'oxydation Swern et Dess-Martin.