2-Butanol - 2-Butanol

|
|
| Des noms | |
|---|---|
|
Nom IUPAC préféré
Butane-2-ol |
|
| Autres noms
sec - butanol
sec alcool - butyl 2-Butanol 2-butyl alcool |
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| 773649 1718764 ( R ) |
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Banque de médicaments | |
| Carte d'information de l'ECHA |
100.001.053 |
| Numéro CE | |
| 1686 396584 ( R ) |
|
| Engrener | 2-butanol |
|
CID PubChem
|
|
| Numéro RTECS | |
| UNII | |
| Numéro ONU | 1120 |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 4 H 10 O | |
| Masse molaire | 74,123 g·mol -1 |
| Densité | 0,808 g cm -3 |
| Point de fusion | -115 °C ; -175 °F; 158 K |
| Point d'ébullition | 98 à 100 °C ; 208 à 212 °F ; 371 à 373 K |
| 290 g/l | |
| log P | 0,683 |
| La pression de vapeur | 1,67 kPa (à 20 °C) |
| Acidité (p K a ) | 17.6 |
| −5.7683 × 10 −5 cm 3 mol −1 | |
|
Indice de réfraction ( n D )
|
1,3978 (à 20 °C) |
| Thermochimie | |
|
Capacité calorifique ( C )
|
197,1 J K -1 mol -1 |
|
Entropie molaire standard ( S |
213,1 J K -1 mol -1 |
|
Std enthalpie de
formation (Δ f H ⦵ 298 ) |
−343,3 à −342,1 kJ mol −1 |
|
Std enthalpie de
combustion (Δ c H ⦵ 298 ) |
-2,6611 à -2,6601 MJ mol -1 |
| Dangers | |
| Fiche de données de sécurité | inchem.org |
| Pictogrammes SGH |
 
|
| Mention d'avertissement SGH | Avertissement |
| H226 , H319 , H335 , H336 | |
| P261 , P305+351+338 | |
| NFPA 704 (diamant de feu) | |
| point de rupture | 22 à 27 °C (72 à 81 °F ; 295 à 300 K) |
| 405 °C (761 °F; 678 K) | |
| Limites d'explosivité | 1,7-9,8% |
| Dose ou concentration létale (LD, LC) : | |
|
LC Lo (le plus bas publié )
|
16 000 ppm (rat, 4 h) 10 670 ppm (souris, 3,75 h) 16 000 ppm (souris, 2,67 h) |
| NIOSH (limites d'exposition pour la santé aux États-Unis) : | |
|
PEL (Autorisé)
|
TWA 150 ppm (450 mg/m 3 ) |
|
REL (recommandé)
|
TWA 100 ppm (305 mg/m 3 ) ST 150 ppm (455 mg/m 3 ) |
|
IDLH (Danger immédiat)
|
2000 ppm |
| Composés apparentés | |
|
Butanols apparentés
|
n -butanol isobutanol tert -butanol |
|
Composés apparentés
|
butanone |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
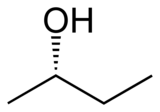
2-butanol , ou sec - butanol , est un composé organique avec la formule C H 3 CH ( O H) CH 2 CH 3 . Cet alcool secondaire est un liquide incolore inflammable qui est soluble dans trois parties d'eau et complètement miscible aux solvants organiques. Il est produit à grande échelle, principalement comme précurseur du solvant industriel méthyléthylcétone . Le 2-butanol est chiral et peut donc être obtenu sous la forme de l'un ou l'autre de deux stéréoisomères désignés par ( R )-(-)-2-butanol et ( S )-(+)-2-butanol. Il se présente normalement sous la forme d'un mélange 1:1 des deux stéréoisomères - un mélange racémique .
 |
|
 |

|
| ( R )-(−)-2-butanol | ( S )-(+)-2-butanol |
Fabrication et applications
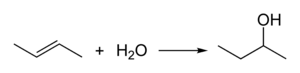
Le 2-butanol est fabriqué industriellement par hydratation du 1-butène ou du 2-butène :
L'acide sulfurique est utilisé comme catalyseur pour cette conversion.
En laboratoire, il peut être préparé par réaction de Grignard en faisant réagir du bromure d'éthylmagnésium avec de l' acétaldéhyde dans de l'éther diéthylique séché ou du tétrahydrofurane .
Bien qu'un peu de 2-butanol soit utilisé comme solvant, il est principalement converti en butanone (méthyléthylcétone, MEK), un important solvant industriel et présent dans de nombreux produits de nettoyage domestiques et décapants pour peinture. Bien que la plupart des décapants pour peinture aient cessé d'utiliser le MEK dans leurs produits en raison de problèmes de santé et de nouvelles lois. Les esters volatils de 2-butanol ont des arômes agréables et sont utilisés en petites quantités comme parfums ou dans les arômes artificiels.
Solubilité
La solubilité répertoriée du 2-butanol est souvent incorrecte, y compris certaines des références les plus connues telles que le Merck Index , le CRC Handbook of Chemistry and Physics et le Lange's Handbook of Chemistry . Même le Programme international sur la sécurité chimique répertorie la mauvaise solubilité. Cette erreur répandue est due au Handbuch der Organischen Chemie de Beilstein ( Manuel de chimie organique ). Ce travail cite une fausse solubilité de 12,5 g/100 g d'eau. De nombreuses autres sources ont utilisé cette solubilité, qui a fait boule de neige et est devenue une erreur répandue dans le monde industriel. Les données correctes (35,0 g/100 g à 20 °C, 29 g/100 g à 25 °C et 22 g/100 g à 30 °C) ont été publiées pour la première fois en 1886 par Alexejew, puis des données similaires ont été rapportées par d'autres scientifiques dont Dolgolenko et Dryer en 1907 et 1913, respectivement.
Précautions
Comme les autres butanols, le 2-butanol a une faible toxicité aiguë. La DL 50 est de 4 400 mg/kg (rat, orale).
Plusieurs explosions ont été signalées lors de la distillation conventionnelle du 2-butanol, apparemment dues à l'accumulation de peroxydes dont le point d'ébullition est supérieur à celui de l'alcool pur (et donc se concentrant dans le pot d'alambic pendant la distillation). Comme les alcools, contrairement aux éthers, ne sont pas largement connus pour être capables de former des impuretés de peroxyde, le danger est susceptible d'être négligé. Le 2-butanol fait partie des produits chimiques de formation de peroxyde de classe B
Les références
Liens externes
- Carte internationale de sécurité chimique 0112
- Guide de poche du NIOSH sur les risques chimiques. "#0077" . Institut national pour la sécurité et la santé au travail (NIOSH).
- Critères de santé environnementale IPCS 65 : Butanols : quatre isomères
- Guide de santé et de sécurité IPCS 4: 2-Butanol