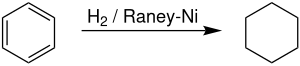Cyclohexane - Cyclohexane
|
|
|||
|
|
|||
| Noms | |||
|---|---|---|---|
|
Nom IUPAC préféré
Cyclohexane |
|||
| Autres noms
Hexanaphtène (archaïque)
|
|||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| 3DMet | |||
| 1900225 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Banque de médicaments | |||
| Carte d'information de l'ECHA |
100.003.461 |
||
| 1662 | |||
| KEGG | |||
|
CID PubChem
|
|||
| Numéro RTECS | |||
| UNII | |||
| Numéro ONU | 1145 | ||
|
Tableau de bord CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriétés | |||
| C 6 H 12 | |||
| Masse molaire | 84,162 g·mol -1 | ||
| Apparence | Liquide incolore | ||
| Odeur | Doux, semblable à l' essence | ||
| Densité | 0,7739 g/mL, liquide ; Densité = 0,996 g/mL, solide | ||
| Point de fusion | 6,47 °C (43,65 °F; 279,62 K) | ||
| Point d'ébullition | 80,74 °C (177,33 °F; 353,89 K) | ||
| Non miscible | |||
| Solubilité | Soluble dans l' éther , l' alcool , l' acétone | ||
| La pression de vapeur | 78 mmHg (20 °C) | ||
| −68,13·10 −6 cm 3 /mol | |||
|
Indice de réfraction ( n D )
|
1.42662 | ||
| Viscosité | 1,02 cP à 17 °C | ||
| Thermochimie | |||
|
Std enthalpie de
formation (Δ f H ⦵ 298 ) |
−156 kJ/mol | ||
|
Std enthalpie de
combustion (Δ c H ⦵ 298 ) |
−3920 kJ/mol | ||
| Dangers | |||
| Fiche de données de sécurité | Voir : page de données | ||
| Pictogrammes SGH |
   
|
||
| Mention d'avertissement SGH | Danger | ||
| H225 , H302 , H305 , H315 , H336 | |||
| P210 , P233 , P240 , P241 , P242 , P243 , P261 , P264 , P271 , P273 , P280 , P301 + 310 , P302 + 352 , P303 + 361 + 353 , P304 + 340 , P312 , P321 , P331 , P332 + 313 , P362 , P370 + 378 , P391 , P403 + 233 , P403 + 235 , P405 | |||
| NFPA 704 (diamant de feu) | |||
| point de rupture | −20 °C (−4 °F; 253 K) | ||
| 245 °C (473 °F; 518 K) | |||
| Limites d'explosivité | 1,3–8% | ||
| Dose ou concentration létale (LD, LC) : | |||
|
DL 50 ( dose médiane )
|
12705 mg/kg (rat, oral) 813 mg/kg (souris, oral) |
||
|
LC Lo (le plus bas publié )
|
17 142 ppm (souris, 2 h ) 26 600 ppm (lapin, 1 h) |
||
| NIOSH (limites d'exposition pour la santé aux États-Unis) : | |||
|
PEL (Autorisé)
|
TWA 300 ppm (1050 mg/m 3 ) | ||
|
REL (recommandé)
|
TWA 300 ppm (1050 mg/m 3 ) | ||
|
IDLH (Danger immédiat)
|
1300 ppm | ||
| Composés apparentés | |||
|
Cycloalcanes apparentés
|
Cyclopentane Cycloheptane |
||
|
Composés apparentés
|
Cyclohexène Benzène |
||
| Page de données supplémentaires | |||
|
Indice de réfraction ( n ), Constante diélectrique (ε r ), etc. |
|||
|
Données thermodynamiques |
Comportement des phases solide-liquide-gaz |
||
| UV , IR , RMN , MS | |||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Références de l'infobox | |||
Le cyclohexane est un cycloalcane de formule moléculaire C 6 H 12 . Le cyclohexane est apolaire . Le cyclohexane est un liquide incolore et inflammable avec une odeur caractéristique de détergent , rappelant les produits de nettoyage (dans lesquels il est parfois utilisé). Le cyclohexane est principalement utilisé pour la production industrielle d'acide adipique et de caprolactame , précurseurs du nylon .
Cyclohexyl ( C 6 H 11 ) est le substituant alkyle du cyclohexane et est abrégé en Cy .
Production
Moderne
A l'échelle industrielle, le cyclohexane est produit par hydrogénation du benzène en présence d'un catalyseur au nickel de Raney . Les producteurs de cyclohexane représentent environ 11,4 % de la demande mondiale de benzène. La réaction est fortement exothermique, avec ΔH(500 K) = -216,37 kJ/mol). La déshydrogénation a commencé sensiblement au-dessus de 300 °C, reflétant l'entropie favorable à la déshydrogénation.
De bonne heure
Contrairement au benzène , le cyclohexane ne se trouve pas dans les ressources naturelles telles que le charbon. Pour cette raison, les premiers chercheurs ont synthétisé leurs échantillons de cyclohexane.
Échec
- En 1867, Marcellin Berthelot a réduit le benzène avec de l'acide iodhydrique à des températures élevées.
- En 1870, Adolf von Baeyer répéta la réaction et prononça le même produit de réaction "hexahydrobenzène"
- en 1890, Vladimir Markovnikov croyait pouvoir distiller le même composé à partir du pétrole du Caucase , appelant sa concoction « hexanaphtène ».
Étonnamment, leurs cyclohexanes bouillaient plus de 10 °C que l'hexahydrobenzène ou l'hexanaphtène, mais cette énigme a été résolue en 1895 par Markovnikov, NM Kishner et Nikolay Zelinsky lorsqu'ils ont réaffecté « hexahydrobenzène » et « hexanaphtène » en tant que méthylcyclopentane , le résultat d'un inattendu réaction de réarrangement .
Succès
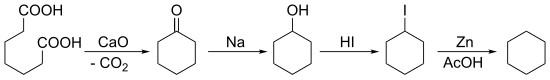
En 1894, Baeyer synthétise le cyclohexane en commençant par une cétonisation de l'acide pimélique suivie de multiples réductions :
La même année, E. Haworth et WH Perkin Jr. (1860-1929) l'ont préparé via une réaction de Wurtz du 1,6-dibromohexane.
Réactions et utilisations
Bien que plutôt non réactif, le cyclohexane subit une oxydation catalytique pour produire de la cyclohexanone et du cyclohexanol . Le mélange cyclohexanone-cyclohexanol, appelé « huile KA », est une matière première pour l'acide adipique et le caprolactame , précurseurs du nylon . Plusieurs millions de kilogrammes de cyclohexanone et de cyclohexanol sont produits chaque année.
Il est utilisé comme solvant dans certaines marques de liquide correcteur. Le cyclohexane est parfois utilisé comme solvant organique non polaire, bien que le n-hexane soit plus largement utilisé à cette fin. Il est fréquemment utilisé comme solvant de recristallisation , car de nombreux composés organiques présentent une bonne solubilité dans le cyclohexane chaud et une faible solubilité à basse température.
Le cyclohexane est également utilisé pour l'étalonnage des instruments de calorimétrie différentielle à balayage (DSC), en raison d'une transition cristal-cristal pratique à -87,1 °C.
La vapeur de cyclohexane est utilisée dans les fours de cémentation sous vide, dans la fabrication d'équipements de traitement thermique.
Conformation
L'anneau de bord à 6 sommets n'a pas la forme d'un hexagone parfait . La conformation d'un hexagone plan 2D plat a une déformation angulaire considérable car ses liaisons ne sont pas de 109,5 degrés ; la déformation en torsion serait également considérable car toutes les liaisons seraient des liaisons éclipsées . Par conséquent, pour réduire la contrainte de torsion , le cyclohexane adopte une structure tridimensionnelle connue sous le nom de conformation de chaise , qui s'interconvertit rapidement à température ambiante via un processus connu sous le nom de retournement de chaise . Lors du chair flip, on rencontre trois autres conformations intermédiaires : la demi-chaise, qui est la conformation la plus instable, la conformation bateau la plus stable, et le twist-boat, qui est plus stable que le bateau mais toujours beaucoup moins stable que la chaise. La chaise et le bateau torsadé sont des minima énergétiques et sont donc des conformateurs, tandis que la demi-chaise et le bateau sont des états de transition et représentent des maxima énergétiques. L'idée que la conformation de la chaise est la structure la plus stable pour le cyclohexane a été proposée pour la première fois en 1890 par Hermann Sachse, mais n'a été largement acceptée que bien plus tard. La nouvelle conformation place les carbones à un angle de 109,5°. La moitié des hydrogènes sont dans le plan de l'anneau ( équatorial ) tandis que l'autre moitié est perpendiculaire au plan ( axial ). Cette conformation permet la structure la plus stable du cyclohexane. Une autre conformation du cyclohexane existe, connue sous le nom de conformation en bateau , mais elle se convertit en une formation de chaise légèrement plus stable. Si le cyclohexane est mono-substitué avec un grand substituant , alors le substituant se trouvera très probablement attaché en position équatoriale, car il s'agit de la conformation légèrement plus stable .
Le cyclohexane a l'angle et la déformation de torsion les plus bas de tous les cycloalcanes; en conséquence, le cyclohexane a été considéré comme un 0 dans la déformation totale du cycle.
Phases solides
Le cyclohexane a deux phases cristallines. La phase I à haute température, stable entre 186 K et le point de fusion 280 K, est un cristal plastique , ce qui signifie que les molécules conservent un certain degré de liberté de rotation. La phase II basse température (inférieure à 186 K) est commandée. Deux autres phases III et IV à basse température (métastables) ont été obtenues par application de pressions modérées supérieures à 30 MPa, où la phase IV apparaît exclusivement dans le cyclohexane deutéré (l'application de pression augmente les valeurs de toutes les températures de transition).
| Non | Symétrie | Groupe d'espace | un (Å) | b (Å) | Californie) | Z | T (K) | P (MPa) |
|---|---|---|---|---|---|---|---|---|
| je | Cubique | Fm3m | 8.61 | 4 | 195 | 0,1 | ||
| II | Monoclinique | C2/c | 11.23 | 6.44 | 8.20 | 4 | 115 | 0,1 |
| III | orthorhombique | pmn | 6,54 | 7,95 | 5.29 | 2 | 235 | 30 |
| IV | Monoclinique | P12(1)/n1 | 6,50 | 7.64 | 5.51 | 4 | 160 | 37 |
Ici Z est le nombre d'unités de structure par cellule unitaire ; les constantes de maille unitaire a, b et c ont été mesurées à la température T et à la pression P données.
Voir également
- La catastrophe de Flixborough , un accident industriel majeur causé par une explosion de cyclohexane.
- Hexane
- Tour d'anneau
- Cyclohexane (page de données)
Les références
- ^ Hexanaphtène Archivé 2018-02-12 à la Wayback Machine , Dictionary.com
- ^ "Avant l'affaire". Nomenclature de la chimie organique : recommandations IUPAC et noms préférés 2013 (Livre bleu) . Cambridge : La Société royale de chimie . 2014. p. P001–P004. doi : 10.1039/9781849733069-FP001 . ISBN 978-0-85404-182-4.
- ^ A b c d e NIOSH Pocket Guide de dangers des produits chimiques. "#0163" . Institut national pour la sécurité et la santé au travail (NIOSH).
- ^ un b "Cyclohexane" . Concentrations de danger immédiat pour la vie ou la santé (IDLH) . Institut national pour la sécurité et la santé au travail (NIOSH).
- ^ Campbell, M. Larry (2011). "Cyclohexane". Encyclopédie de chimie industrielle d'Ullmann . doi : 10.1002/14356007.a08_209.pub2 . ISBN 978-3527306732.
- ^ "Abréviations et acronymes standard" (PDF) . Le Journal de Chimie Organique.
- ^ Fred Fan Zhang, Thomas van Rijnman, Ji Soo Kim, Allen Cheng "Sur les méthodes actuelles d'hydrogénation des composés aromatiques, 1945 à nos jours" Lunds Tekniska Högskola 2008
- ^ Ceresana. "Benzène - Etude : Marché, Analyse, Tendances 2021 - Ceresana" . www.ceresana.com . Archivé de l'original le 21 décembre 2017 . Consulté le 4 mai 2018 .
- ^ un b Michael Tuttle Musser (2005). « Cyclohexanol et cyclohexanone ». Encyclopédie de chimie industrielle d'Ullmann . Weinheim : Wiley-VCH. doi : 10.1002/14356007.a08_217 . ISBN 978-3527306732.
- ^ Warnhoff, EW (1996). « Les histoires curieusement entrelacées du benzène et du cyclohexane ». J. Chem. Éduc. 73 (6): 494. bibcode : 1996JChEd..73..494W . doi : 10.1021/ed073p494 .
- ^ Bertholet (1867) "Nouvelles applications des méthodes de réduction en chimie organique" , Bulletin de la Société chimique de Paris , série 2, 7 : 53-65.
- ^ Bertholet (1868) "Méthode universelle pour réduire et saturer d'hydrogène les composés organiques" (Méthode universelle pour réduire et saturer les composés organiques avec de l'hydrogène), Bulletin de la Société chimique de Paris , série 2, 9 : 8-31. À partir de la page 17 : "En effet, la benzine, chauffée à 280° pendant 24 heures avec 80 fois son poids d'une solution saturée à froid d'acide iodhydrique, se change à peu près entièrement en hydrure d'hexylène, C 12 H 14 , en fixant 4 fois son volume d'hydrogène: C 12 H 6 + 4H 2 = C 12 H 14 … Le nouveau carburateur formé par la benzine est un corps unique et défini: il bout à 69°, et offre toutes les propriétés et la composition de l'hydrure d'hexylène extrait des pétroles." (En effet, le benzène, chauffé à 280° pendant 24 heures avec 80 fois son poids d'une solution aqueuse d'acide iodhydrique saturé froid, est changé presque entièrement en hydrure d'hexylène, C 12 H 14 , [Note : cette formule pour l'hexane ( C 6 H 14 ) est faux car les chimistes de l'époque utilisaient la masse atomique incorrecte pour le carbone.] en fixant [ie, en combinant avec] 4 fois son volume d'hydrogène : C 12 H 6 + 4H 2 = C 12 H 14 … Le Le nouveau composé carboné formé par le benzène est une substance unique et bien définie : il bout à 69° et présente toutes les propriétés et la composition de l'hydrure d'hexylène extrait du pétrole.)
- ^ Adolf Baeyer (1870) "Ueber die Reduction aromatischer Kohlenwasserstoffe durch Jodphosphonium" (Sur la réduction des composés aromatiques par l'iodure de phosphonium [H 4 IP]), Annalen der Chemie und Pharmacie , 155 : 266-281. À partir de la page 279 : "Bei der Reduction mit Natriumamalgam oder Jodphosphonium addiren sich im höchsten Falle sechs Atome Wasserstoff, und es entstehen Abkömmlinge, die sich von einem Kohlenwasserstoff C 6 H 12 ableiten. Dieser Kohlenwasserstoff ist allerner Wa , das Hexahydromesitylen und Hexahydromellithsäure, mit Leichtigkeit wieder in Benzolabkömmlinge übergeführt werden können." (Au cours de la réduction [du benzène] avec l'amalgame de sodium ou l'iodure de phosphonium, six atomes d'hydrogène sont ajoutés dans le cas extrême, et il se produit des dérivés, qui dérivent d'un hydrocarbure C 6 H 12 . Cet hydrocarbure est selon toute probabilité un cycle fermé , puisque ses dérivés — l'hexahydromésitylène [1,3,5 - triméthyl cyclohexane] et l'acide hexahydromellithique [acide cyclohexane-1,2,3,4,5,6-hexacarboxylique] — peuvent être facilement reconvertis en dérivés du benzène.)
- ^ Prix, DM (1995). "Étalonnage de la température des calorimètres à balayage différentiel". Journal d'analyse thermique . 45 (6) : 1285-1296. doi : 10.1007/BF02547423 .
- ^ un b Mayer, J.; Urbain, S.; Habrylo, S.; Holderna, K.; Natkaniec, I.; Würflinger, A.; Zajac, W. (1991). "Études de diffusion de neutrons de C6H12 et C6D12 Cyclohexane sous haute pression". Statut Physique Solidi B . 166 (2): 381. bibcode : 1991PSSBR.166..381M . doi : 10.1002/pssb.2221660207 .
Liens externes
- Carte internationale de sécurité chimique 0242
- Inventaire national des polluants – Fiche d'information sur le cyclohexane
- Guide de poche NIOSH sur les risques chimiques
- Cyclohexane@3Dchem
- Hermann Sachse et la première suggestion d'une conformation de chaise.
- Banque de données NLM sur les substances dangereuses – Cyclohexane
- Du méthanol découvert dans l'espace
- Calcul de la pression de vapeur , de la densité du liquide , de la viscosité dynamique du liquide , de la tension superficielle du cyclohexane
- Schéma de procédé de production de cyclohexane, technique d'hydrogénation du benzène