Enamine - Enamine
Une énamine est un composé insaturé dérivé de la condensation d'un aldéhyde ou d'une cétone avec une amine secondaire . Les énamines sont des intermédiaires polyvalents.
Le mot "énamine" est dérivé de l'affixe en -, utilisé comme suffixe d' alcène , et de la racine amine . Cela peut être comparé à l' énol , qui est un groupe fonctionnel contenant à la fois un alcène ( en- ) et un alcool ( -ol ). Les énamines sont considérées comme des analogues azotés des énols.
Si l'un des substituants azotés est un atome d'hydrogène, H, il s'agit de la forme tautomère d'une imine . Cela se réorganisera généralement à l'imine; cependant il y a plusieurs exceptions (comme l' aniline ). La tautomérie énamine-imine peut être considérée comme analogue à la tautomérie céto-énol . Dans les deux cas, un atome d'hydrogène bascule son emplacement entre l'hétéroatome (oxygène ou azote) et le deuxième atome de carbone.
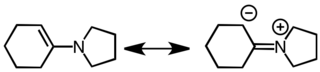
Les énamines sont à la fois de bons nucléophiles et de bonnes bases. Leur comportement en tant que nucléophiles à base de carbone est expliqué en référence aux structures de résonance suivantes.
Formation
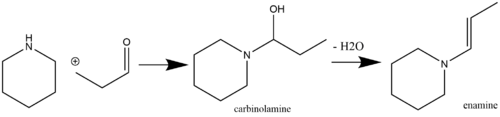
Les énamines sont des fragments labiles et donc chimiquement utiles qui peuvent être facilement produits à partir de réactifs de départ disponibles dans le commerce. Une voie courante pour la production d'énamine est via une réaction nucléophile catalysée par un acide d'espèces cétone (Stork, 1963) ou aldéhyde (Mannich/Davidsen, 1936) contenant un hydrogène avec des amines secondaires. La catalyse acide n'est pas toujours nécessaire, si le pKa de l'aminé réagissant est suffisamment élevé (par exemple, la pyrrolidine , qui a un pKa de 11,26). Si le pKa de l' aminé réagissant est faible, cependant, alors une catalyse acide est requise à la fois par les étapes d'addition et de déshydratation (les agents déshydratants courants incluent MgSO 4 et Na 2 SO 4 ). Les amines primaires ne sont généralement pas utilisées pour la synthèse d'énamine en raison de la formation préférentielle d'espèces imine plus thermodynamiquement stables. L'autocondensation de la méthylcétone est une réaction secondaire qui peut être évitée par l'ajout de TiCl 4 dans le mélange réactionnel (pour agir comme un capteur d'eau). Un exemple d'aldéhyde réagissant avec une amine secondaire pour former une énamine via un intermédiaire carbinolamine est présenté ci-dessous :
Réactions
Alkylation
Même si les énamines sont plus nucléophiles que leurs homologues énoliques, elles peuvent toujours réagir de manière sélective, les rendant utiles pour les réactions d'alkylation. L'énamine nucléophile peut attaquer les haloalcanes pour former l' intermédiaire sel d' iminium alkylé qui s'hydrolyse ensuite pour régénérer une cétone (un matériau de départ dans la synthèse d'énamine). Cette réaction a été lancée par Gilbert Stork et est parfois désignée par le nom de son inventeur. De manière analogue, cette réaction peut être utilisée comme moyen efficace d'acylation. Une variété d'agents d'alkylation et d'acylation comprenant des halogénures benzyliques et allyliques peuvent être utilisés dans cette réaction.
Acylation
Dans une réaction très similaire à l'alkylation des énamines, les énamines peuvent être acylées pour former un produit dicarbonyle final. L'énamine de départ subit une addition nucléophile aux halogénures d'acyle formant l'intermédiaire sel d'iminium qui peut s'hydrolyser en présence d'acide.
Métalloénamines
Des bases fortes telles que LiNR2 peuvent être utilisées pour déprotoner les imines et former des métalloénamines. Les métalloénamines peuvent s'avérer synthétiquement utiles en raison de leur nucléophilie (elles sont plus nucléophiles que les énolates). Ainsi, ils sont mieux à même de réagir avec des électrophiles plus faibles (par exemple, ils peuvent être utilisés pour ouvrir des époxydes.) Plus particulièrement, ces réactions ont permis des alkylations asymétriques de cétones par transformation en métalloénamines intermédiaires chirales.
Halogénation
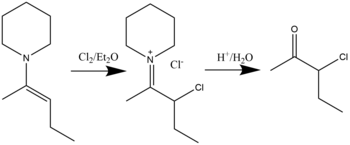
Les composés β-halo-immonium peuvent être synthétisés par réaction d'énamines avec des halogénures dans un solvant d'éther diéthylique. L'hydrolyse entraînera la formation de α-halo cétones. La chloration, la bromation et même l'iodation se sont avérées possibles. La réaction générale est illustrée ci-dessous :
Couplage oxydant
Les énamines peuvent être efficacement couplées avec des énols silanes par traitement avec du nitrate d'ammonium Ce(IV). Ces réactions ont été signalées par le groupe de Narasaka en 1935, fournissant une voie vers des énamines stables ainsi qu'un exemple de dicétone 1,4 (dérivé d'un réactif amine morpholine). Plus tard, ces résultats ont été exploités par le groupe MacMillan avec le développement d'un organocatalyseur qui a utilisé les substrats de Narasaka pour produire des 1,4 dicarbonyles de manière énantiosélective, avec de bons rendements. La dimérisation oxydative des aldéhydes en présence d'amines passe par la formation d'une énamine suivie d'une formation finale de pyrrole. Cette méthode de synthèse symétrique du pyrrole a été développée en 2010 par le groupe Jia, en tant que nouvelle voie précieuse pour la synthèse de produits naturels contenant du pyrrole.
Annulation
La chimie des énamines a été mise en œuvre dans le but de produire une version énantiosélective à un pot de l' annulation de Robinson . L' annulation de Robinson , publiée par Robert Robinson en 1935, est une réaction catalysée par une base qui combine une cétone et une méthylvinylcétone (généralement abrégée en MVK) pour former un système de cycle fusionné de cyclohexénone. Cette réaction peut être catalysée par la proline pour passer par des intermédiaires chiraux d'énamine qui permettent une bonne stéréosélectivité. Ceci est important, en particulier dans le domaine de la synthèse de produits naturels, par exemple pour la synthèse de la cétone Wieland-Mescher - un élément vital pour des molécules biologiquement actives plus complexes.
Réactivité
Les énamines agissent comme des nucléophiles qui nécessitent moins d'activation acide/base pour la réactivité que leurs homologues énolates. Il a également été démontré qu'ils offrent une plus grande sélectivité avec moins de réactions secondaires. Il existe un gradient de réactivité entre les différents types d'énamine, avec une plus grande réactivité offerte par les énamines cétoniques que leurs homologues aldéhydes. Les énamines cétoniques cycliques suivent une tendance de réactivité où le cycle à cinq chaînons est le plus réactif en raison de sa conformation plane au maximum à l'azote, suivant la tendance 5>8>6>7 (le cycle à sept chaînons étant le moins réactif). Cette tendance a été attribuée à la quantité de caractère p sur l'orbitale à paire isolée d'azote - le caractère p plus élevé correspondant à une plus grande nucléophilie car l'orbitale p permettrait un don dans l'orbitale alcène . De manière analogue, si la paire isolée N participe à des interactions stéréoélectroniques sur la fraction amine, la paire isolée sortira du plan (se pyramidalisera) et compromettra le don dans la liaison π CC adjacente.
Il existe de nombreuses façons de moduler la réactivité de l'énamine en plus de modifier le stérique/l'électronique au centre de l'azote, notamment en changeant la température, le solvant, les quantités d'autres réactifs et le type d'électrophile. Le réglage de ces paramètres permet la formation préférentielle d'énamines E/Z et affecte également la formation de l'énamine plus/moins substituée à partir du matériau de départ cétone.
Voir également
- Enders la réaction d'hydrazone-alkylation SAMP/RAMP
- Réaction Hajos-Parrish-Eder-Sauer-Wiechert
- Ajout de Michael
- Synthèse de l'indole de Nenitzescu
- Organocatalyse
- Annulation Robinson
- Cigogne énamine alkylation
- Réaction de Thorpe
- Fluoxymestérone