Cellule de garde - Guard cell
Les cellules de garde sont des cellules végétales spécialisées dans l'épiderme des feuilles, des tiges et d'autres organes qui sont utilisées pour contrôler les échanges gazeux. Ils sont produits par paires avec un espace entre eux qui forme un pore stomatique. Les pores stomatiques sont plus grands lorsque l'eau est librement disponible et les cellules de garde turgescentes , et fermées lorsque la disponibilité en eau est critiquement faible et que les cellules de garde deviennent flasques. La photosynthèse dépend de la diffusion du dioxyde de carbone (CO 2 ) de l'air à travers les stomates dans les tissus du mésophylle . L'oxygène (O 2 ), produit comme sous - produit de la photosynthèse, sort de la plante par les stomates. Lorsque les stomates sont ouverts, l'eau est perdue par évaporation et doit être remplacée via le flux de transpiration , par de l'eau absorbée par les racines. Les plantes doivent équilibrer la quantité de CO 2 absorbée de l'air avec la perte d'eau à travers les pores stomatiques, et ceci est réalisé par un contrôle à la fois actif et passif de la pression de turgescence des cellules de garde et de la taille des pores stomatiques.
Fonction de cellule de garde
Les cellules de garde sont des cellules entourant chaque stomie . Ils aident à réguler le taux de transpiration en ouvrant et en fermant les stomates. La lumière est le déclencheur principal de l'ouverture ou de la fermeture. Chaque cellule de garde a une cuticule relativement épaisse du côté des pores et une fine en face. Au fur et à mesure que l'eau pénètre dans la cellule, le côté mince se gonfle vers l'extérieur comme un ballon et entraîne le côté épais avec lui, formant un croissant ; les croissants combinés forment l'ouverture du pore.
Les cellules de garde contiennent des protéines phototropines qui sont des sérine et thréonine kinases avec une activité photoréceptrice de lumière bleue. Les phototrophines contiennent deux domaines de lumière, d'oxygène et de capteur de tension (LOV) et font partie de la superfamille des domaines PAS. Les phototropines déclenchent de nombreuses réponses telles que le phototropisme, le mouvement des chloroplastes et l'expansion des feuilles ainsi que l'ouverture des stomates. On ne savait pas grand-chose sur le fonctionnement de ces photorécepteurs avant environ 1998. Le mécanisme par lequel les phototropines fonctionnent a été élucidé grâce à des expériences avec la fève ( Vicia faba ). L'immunodétection et le transfert de far-western ont montré que la lumière bleue excite la phototropine 1 et la phototropine 2, provoquant le début d'une cascade de phosphorylation par la protéine phosphatase 1 , qui active la H + -ATPase, une pompe responsable du pompage des ions H + hors de la cellule. La H + -ATPase phosphorylée permet la liaison d'une protéine 14-3-3 à un domaine auto-inhibiteur de la H + -ATPase à l'extrémité C terminale. La sérine et la thréonine sont ensuite phosphorylées au sein de la protéine, ce qui induit l'activité H + -ATPase. La même expérience a également révélé que lors de la phosphorylation, une protéine 14-3-3 était liée aux phototropines avant que la H + -ATPase n'ait été phosphorylée. Dans une expérience similaire, ils ont conclu que la liaison de la protéine 14-3-3 au site de phosphorylation est essentielle pour l'activation de l' activité H + -ATPase de la membrane plasmique . Cela a été fait en ajoutant des phosphopeptides tels que le P-950, qui inhibe la liaison de la protéine 14-3-3, à la H + -ATPase phosphorylée et en observant la séquence d'acides aminés. Au fur et à mesure que les protons sont pompés, un potentiel électrique négatif s'est formé à travers la membrane plasmique. Cette hyperpolarisation de la membrane a permis l'accumulation d' ions potassium (K + ) et chlorure (Cl − ) chargés , qui à leur tour augmentent la concentration de soluté, provoquant une diminution du potentiel hydrique. Le potentiel hydrique négatif permet à l'osmose de se produire dans la cellule de garde, de sorte que l'eau pénètre, permettant à la cellule de devenir turgescente.
L'ouverture et la fermeture du pore stomatique sont médiées par des changements dans la pression de turgescence des deux cellules de garde. La pression de turgescence des cellules de garde est contrôlée par les mouvements de grandes quantités d'ions et de sucres dans et hors des cellules de garde. Les cellules de garde ont des parois cellulaires d'épaisseur variable (sa région interne, adjacente au pore stomatique est plus épaisse et hautement cutinisée) et des microfibres de cellulose orientées différemment, les faisant se plier vers l'extérieur lorsqu'elles sont turgescentes, ce qui à son tour provoque l'ouverture des stomates. Les stomates se ferment lorsqu'il y a une perte osmotique d'eau, résultant de la perte de K + vers les cellules voisines, principalement les ions potassium (K + )
Perte d'eau et efficacité d'utilisation de l'eau
Le stress hydrique (sécheresse et stress salin) est l'un des problèmes environnementaux majeurs causant de graves pertes dans l'agriculture et dans la nature. La tolérance à la sécheresse des plantes est médiée par plusieurs mécanismes qui fonctionnent ensemble, notamment la stabilisation et la protection de la plante contre les dommages causés par la dessiccation et le contrôle de la quantité d'eau que les plantes perdent par les pores des stomates pendant la sécheresse. Une hormone végétale, l'acide abscissique (ABA), est produite en réponse à la sécheresse. Un type majeur de récepteur ABA a été identifié. L'hormone végétale ABA provoque la fermeture des pores des stomates en réponse à la sécheresse, ce qui réduit la perte d'eau des plantes par transpiration dans l'atmosphère et permet aux plantes d'éviter ou de ralentir la perte d'eau pendant les sécheresses. L'utilisation de plantes cultivées résistantes à la sécheresse conduirait à une réduction des pertes de récoltes pendant les sécheresses. Étant donné que les cellules de garde contrôlent la perte d'eau des plantes, l'enquête sur la façon dont l'ouverture et la fermeture des stomates sont régulées pourrait conduire au développement de plantes avec un meilleur évitement ou un ralentissement de la dessiccation et une meilleure efficacité d'utilisation de l'eau . Les recherches effectuées par Jean-Pierre Rona montrent que l'ABA est le déclencheur de la fermeture de l'ouverture stomatique. Pour déclencher cela, il active la libération d'anions et d'ions potassium. Cet afflux d'anions provoque une dépolarisation de la membrane plasmique. Cette dépolarisation déclenche le potassium plus les ions dans la cellule pour quitter la cellule en raison du déséquilibre du potentiel membranaire. Ce changement soudain des concentrations d'ions provoque le rétrécissement de la cellule de garde, ce qui provoque la fermeture des stomates, ce qui diminue la quantité d'eau perdue. Tout cela est une réaction en chaîne selon ses recherches. L'augmentation de l'ABA entraîne une augmentation de la concentration en ions calcium. Bien qu'au début, ils pensaient que c'était une coïncidence, ils ont découvert plus tard que cette augmentation du calcium est importante. Ils ont découvert que les ions Ca2+ sont impliqués dans l'activation du canal anionique, ce qui permet aux anions de s'écouler dans la cellule de garde. Ils sont également impliqués dans l'interdiction de la proton ATPase de corriger et d'arrêter la dépolarisation de la membrane. Pour étayer leur hypothèse selon laquelle le calcium était responsable de tous ces changements dans la cellule, ils ont fait une expérience où ils ont utilisé des protéines qui inhibaient la production des ions calcium. S'ils supposaient que le calcium est important dans ces processus, ils verraient qu'avec les inhibiteurs, ils verraient moins des choses suivantes. Leur hypothèse était correcte et lorsque les inhibiteurs ont été utilisés, ils ont vu que le proton ATPase fonctionnait mieux pour équilibrer la dépolarisation. Ils ont également constaté que le flux d'anions dans les cellules de garde n'était pas aussi fort. Ceci est important pour que les ions circulent dans la cellule de garde. Ces deux choses sont cruciales pour fermer l'ouverture des stomates, empêchant ainsi la perte d'eau pour la plante.
Absorption et libération d'ions
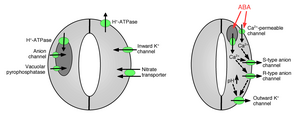
L'absorption d'ions dans les cellules de garde provoque l'ouverture des stomates : l'ouverture des pores d'échange gazeux nécessite l'absorption d'ions potassium dans les cellules de garde. Des canaux et des pompes potassiques ont été identifiés et ont montré qu'ils fonctionnaient dans l'absorption des ions et l'ouverture des ouvertures stomatiques. La libération d'ions par les cellules de garde provoque la fermeture des pores des stomates : d'autres canaux ioniques ont été identifiés comme médiateurs de la libération d'ions des cellules de garde, ce qui entraîne un écoulement d'eau osmotique des cellules de garde en raison de l' osmose , du rétrécissement des cellules de garde et de la fermeture des pores des stomates ( Figures 1 et 2). Des canaux d'efflux potassiques spécialisés participent à la libération du potassium par les cellules de garde. Les canaux anioniques ont été identifiés comme des contrôleurs importants de la fermeture des stomates. Les canaux anioniques ont plusieurs fonctions principales dans le contrôle de la fermeture des stomates : (a) Ils permettent la libération d'anions, tels que le chlorure et le malate des cellules de garde, ce qui est nécessaire à la fermeture des stomates. (b) Les canaux anioniques sont activés par des signaux qui provoquent la fermeture des stomates, par exemple par le calcium intracellulaire et l'ABA. La libération résultante d'anions chargés négativement par les cellules de garde entraîne un déplacement électrique de la membrane vers des tensions plus positives ( dépolarisation ) à la surface intracellulaire de la membrane plasmique des cellules de garde . Cette dépolarisation électrique des cellules de garde conduit à l'activation des canaux potassiques sortants et à la libération de potassium par ces canaux. Au moins deux types principaux de canaux anioniques ont été caractérisés dans la membrane plasmique : les canaux anioniques de type S et les canaux anioniques de type R.
Transport ionique vacuolaire
Les vacuoles sont de grands organites de stockage intracellulaire dans les cellules végétales. En plus des canaux ioniques dans la membrane plasmique, les canaux ioniques vacuolaires ont des fonctions importantes dans la régulation de l'ouverture et de la fermeture des stomates car les vacuoles peuvent occuper jusqu'à 90 % du volume de la cellule de garde. Par conséquent, une majorité d'ions sont libérés des vacuoles lorsque les stomates sont fermés. Les canaux vasculaires K + (VK) et les canaux vacuolaires rapides peuvent médier la libération de K + par les vacuoles. Les canaux vacuolaires K + (VK) sont activés par élévation de la concentration intracellulaire en calcium. Un autre type de canal activé par le calcium est le canal vacuolaire lent (SV). Il a été démontré que les canaux SV fonctionnent comme des canaux cationiques perméables aux ions Ca 2+ , mais leurs fonctions exactes ne sont pas encore connues dans les plantes.
Les cellules de garde contrôlent l'échange de gaz et l'échange d'ions par l'ouverture et la fermeture. K+ est un ion qui entre et sort de la cellule, provoquant le développement d'une charge positive. Le malate est l'un des principaux anions utilisés pour contrer cette charge positive, et il est déplacé à travers le canal ionique AtALMT6. AtALMT6 est un transporteur de malate activé par l'aluminium qui se trouve dans les cellules de garde, en particulier dans les vacuoles. Ce canal de transport s'est avéré provoquer un afflux ou un efflux de malate en fonction des concentrations de calcium. Dans une étude de Meyer et al, des expériences de patch-clamp ont été menées sur les vacuoles du mésophylle d'arabidopsis rdr6-11 (WT) et d'arabidopsis qui surexprimaient AtALMT6-GFP. Il a été découvert à partir de ces expériences que dans le WT, il n'y avait que de petits courants lorsque des ions calcium étaient introduits, tandis que dans le mutant AtALMT6-GFP, un énorme courant de redressement vers l'intérieur était observé. Lorsque le transporteur est éliminé des vacuoles des cellules de garde, il y a une réduction significative du courant de flux de malate. Le courant passe d'un énorme courant entrant à peu différent du WT, et Meyer et al ont émis l'hypothèse que cela est dû aux concentrations résiduelles de malate dans la vacuole. Il existe également une réponse similaire chez les mutants knock-out à la sécheresse comme dans le WT. Aucune différence phénotypique n'a été observée entre les mutants knock-out, le type sauvage ou les mutants AtALMT6-GFP, et la cause exacte n'est pas entièrement connue.
Transduction du signal
Les cellules de garde perçoivent et traitent les stimuli environnementaux et endogènes tels que la lumière, l'humidité, la concentration de CO 2 , la température, la sécheresse et les hormones végétales pour déclencher des réponses cellulaires entraînant l'ouverture ou la fermeture des stomates. Ces voies de transduction du signal déterminent par exemple à quelle vitesse une plante perdra de l'eau pendant une période de sécheresse. Les cellules de garde sont devenues un modèle de signalisation unicellulaire. À l'aide d' Arabidopsis thaliana , l'étude du traitement du signal dans les cellules de garde unique s'est ouverte à la puissance de la génétique . Des protéines cytosoliques et nucléaires et des messagers chimiques qui fonctionnent dans les mouvements stomatiques ont été identifiés et interviennent dans la transduction des signaux environnementaux contrôlant ainsi l' apport de CO 2 dans les plantes et la perte d'eau des plantes. La recherche sur les mécanismes de transduction du signal des cellules de garde permet de comprendre comment les plantes peuvent améliorer leur réponse au stress hydrique en réduisant la perte d'eau des plantes. Les cellules de garde constituent également un excellent modèle pour les études de base sur la façon dont une cellule intègre de nombreux types de signaux d'entrée pour produire une réponse (ouverture ou fermeture des stomates). Ces réponses nécessitent la coordination de nombreux processus biologiques cellulaires dans les cellules de garde, notamment la réception du signal, la régulation des canaux ioniques et de la pompe, le trafic membranaire , la transcription , les réarrangements du cytosquelette , etc. Un défi pour la recherche future est d'attribuer les fonctions de certaines des protéines identifiées à ces divers processus biologiques cellulaires.
Développement
Au cours du développement des feuilles des plantes, les cellules de garde spécialisées se différencient des « cellules mères de garde ». La densité des pores stomatiques dans les feuilles est régulée par des signaux environnementaux, notamment l'augmentation de la concentration de CO 2 atmosphérique , qui réduit la densité des pores stomatiques à la surface des feuilles de nombreuses espèces végétales par des mécanismes actuellement inconnus. La génétique du développement stomatique peut être étudiée directement par imagerie de l'épiderme foliaire à l'aide d'un microscope. Plusieurs protéines de contrôle majeures qui fonctionnent dans une voie de médiation du développement des cellules de garde et des pores stomatiques ont été identifiées.