Hydrocyanation - Hydrocyanation
En chimie, l' hydrocyanation est un procédé de conversion des alcènes en nitriles . La réaction implique l'ajout de cyanure d'hydrogène et nécessite un catalyseur . Cette conversion est réalisée à l'échelle industrielle pour la production de précurseurs de nylon.
Hydrocyanation des alcènes non activés
Industriellement, l'hydrocyanation est couramment réalisée sur des alcènes catalysés par des complexes de nickel de ligands phosphites (P(OR) 3 ). Une réaction générale est montrée :
- RCH=CH 2 + HCN → RCH 2 -CH 2 -CN
Stœchiométrie et mécanisme
La réaction implique l'ajout de H + et – CN au substrat . Habituellement, le substrat est un alcène et le produit est un nitrile .
La réaction se déroule via l' addition oxydante de HCN à un complexe métallique de faible valence pour donner un complexe hydrido cyanure . Après liaison de l'alcène donne le M (H) (CN) intermédiaire L n (alcène), qui subit ensuite une insertion migratoire pour donner un cyanure alkylmétal. Le cycle est complété par l' élimination réductrice du nitrile.
Les acides de Lewis , tels que B(C 6 H 5 ) 3 induisent une élimination réductrice du produit nitrile, augmentant les vitesses.
Dans le cas des systèmes à base de nickel, la désactivation du catalyseur implique la formation d'espèces dicyanonickel(II), qui ne réagissent pas vis-à-vis des alcènes. Le dicyanure se forme par deux voies (L = phosphite) :
- Ni(H)(CN)L 2 + HCN → Ni(CN) 2 L 2 + H 2
- Ni(R)(CN)L 2 + HCN → Ni(CN) 2 L 2 + RH
Hydrocyanation asymétrique
La plupart des alcènes sont prochiraux, ce qui signifie dans ce contexte que leur hydrocyanation génère des nitriles chiraux. Les catalyseurs d'hydrocyanation classiques, par exemple Ni(P(OR) 3 ) 4 , catalysent la formation de mélanges racémiques. Cependant, lorsque les ligands supports sont chiraux, l'hydrocyanation peut être hautement énantiosélective . Pour l'hydrocyanation asymétrique, les ligands chiraux populaires sont les complexes chélateurs d' aryle diphosphite.
Applications
L'application industrielle la plus importante est la synthèse catalysée par le nickel de la synthèse d' adiponitrile (NC–(CH 2 ) 4 –CN) à partir de buta-1,3-diène (CH 2 =CH–CH=CH 2 ). L'adiponitrile est un précurseur de l' hexaméthylènediamine (H 2 N–(CH 2 ) 6 –NH 2 ), qui est utilisé pour la production de certains types de nylon . Le procédé ADN de DuPont pour donner de l'adiponitrile est illustré ci-dessous :
Ce procédé comprend trois étapes : une hydrocyanation du butadiène en un mélange de 2-méthyl-butène-3-nitrile (2M3BM) et de pentène-3-nitrile (3PN), une étape d' isomérisation de 2M3BM (non souhaité) à 3PN et une seconde l'hydrocyanation (aidée par un cocatalyseur acide de Lewis tel que le trichlorure d'aluminium ou le triphénylbore) en adiponitrile.
Hydrocyanation asymétrique
L'hydrocyanation est importante en raison de la polyvalence des alkyl nitriles (RCN), qui sont des intermédiaires importants pour les synthèses d' amides , d' amines , d'acides carboxyliques et d' esters .
Le naproxène , un médicament anti-inflammatoire , est préparé via une hydrocyanation asymétrique d'un vinylnaphtalène utilisant un ligand phosphinite (OPR 2 ), L . L'énantiosélectivité de cette réaction est importante car seul l' énantiomère S est médicalement souhaitable, tandis que l'énantiomère R produit des effets nocifs sur la santé. Cette réaction peut produire l'énantiomère S avec une stéréosélectivité > 90 % . Lors de la recristallisation du produit brut, le nitrile optiquement pur peut être obtenu.
Histoire
L'hydrocyanation a été signalée pour la première fois par Arthur et Pratt en 1954, lorsqu'ils ont catalysé de manière homogène l'hydrocyanation des alcènes linéaires. Le procédé industriel d'hydrocyanation catalytique du butadiène en adiponitrile a été inventé par William C. Drinkard .
Transhydrocyanation
Dans la transhydrocyanation , un équivalent de HCN est transféré d'une cyanhydrine, par exemple la cyanhydrine d'acétone , vers un autre accepteur de HCN. Le transfert est un processus d'équilibre, initié par la base. La réaction peut être conduite par des réactions de piégeage ou par l'utilisation d'un accepteur de HCN supérieur, tel qu'un aldéhyde.
Hydrocyanation de composés carbonylés insaturés
Les composés carbonylés α,β-insaturés subissent une hydrocyanation en l'absence de catalyseurs métalliques. Une manifestation est un cas particulier de la réaction de Michael , conduisant à des -cyanocétones. Une autre manifestation conduit aux vinylcyanhydrines. Des -cyano-cyanhydrines sont également observées. Les conditions de réaction permettent d'accéder à n'importe lequel de ces produits.
(1)
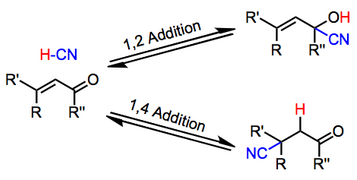
Les conditions généralement acides favorisent les adduits 1,2, tandis que les conditions basiques favorisent les adduits 1,4. Les additions de cyanures de métaux alcalins , par exemple, conduisent exclusivement à une addition 1,4. Contrairement aux cyanures et cyanoaluminates de métaux alcalins, les cyanures acides de Lewis, tels que le TMSCN , favorisent l'addition 1,2. Les substrats acétyléniques subissent la réaction ; cependant, la portée de cette réaction est limitée et les rendements sont souvent faibles.
(5)

L'addition de 1,4 aux imines a été observée dans quelques cas, bien que les imines soient souvent labiles aux bases.
(6)

Les esters, nitriles et autres dérivés carbonylés subissent également une hydrocyanation conjugative.
Lorsqu'on utilise des cyanures alcalins, une neutralisation au moins partielle du milieu réactionnel est généralement nécessaire. La neutralisation peut être accomplie par un groupe acide sur le sous-état lui-même (neutralisation interne). ou par l'ajout d'un acide externe (neutralisation externe). L'acide acétique est couramment utilisé à cette fin, dans une procédure mise au point par Lapworth.
(7)

L'hydrocyanation conjugative a été utilisée pour préparer le cycle D stéroïdien. La diastéréosélectivité est généralement élevée dans ces réactions d'addition, et les composés β-cyano carbonyle résultants peuvent être convertis en un certain nombre de produits stéroïdiens.

