Hyponitrite - Hyponitrite
|
|
|||
| Des noms | |||
|---|---|---|---|
|
Nom IUPAC préféré
Hyponitrite |
|||
|
Nom IUPAC systématique
Diazènebis (olate) |
|||
| Autres noms
Hyponitrite (2–)
|
|||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| 3DMet | |||
| ChEBI | |||
| ChemSpider | |||
| 130273 | |||
| KEGG | |||
|
PubChem CID
|
|||
|
|||
|
|||
| Propriétés | |||
|
N 2 O 2− 2 |
|||
| Masse molaire | 60,012 g · mol −1 | ||
| Acide conjugué | Acide hyponitreux | ||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 ° C [77 ° F], 100 kPa). |
|||
| Références Infobox | |||
En chimie , l' hyponitrite peut désigner l' anion N
2 O 2−
2 ([ON = NO] 2− ), ou à tout composé ionique qui le contient. En chimie organique , il peut aussi désigner le groupe -O-N = N-O-, ou tout composé organique de formule générique R 1 -O-N = N-O-R 2 , où R 1 et R 2 sont groupes organiques. Ces composés peuvent être considérés comme des sels et des esters respectivement d' acide hyponitreux H
2 N
2 O
2 ou HON = NOH.
Un hyponitrite acide est un composé ionique avec l'anion HN
2 O -
2 ([HON = NON] - ).
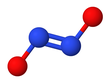
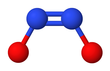
Ion hyponitrite
L'hyponitrite présente une isomérie cis – trans .
La forme trans ( E ) se trouve généralement dans les sels d'hyponitrite tels que l'hyponitrite de sodium ( Na
2 N
2 O
2 ) et hyponitrite d'argent (I) ( Ag
2 N
2 O
2 ).
La forme cis ( Z ) de l'hyponitrite de sodium peut également être obtenue, et elle est plus réactive que la forme trans . L' anion cis hyponitrite est presque plan et presque symétrique, avec des longueurs d'environ 140 pm pour la liaison N-O et 120 pm pour la liaison N-N, et des angles O-N-N d'environ 119 °.
Réactions
Les ions hyponitrite peuvent agir comme un ligand bidenté soit en mode pontage soit en mode chélatant. Il existe un groupe cis- hyponitrite pontant dans la forme dinucléaire rouge du chlorure de nitrosyl pentammine cobalt (III), [Co (NH 3 ) 5 NO] Cl 2 .
L'hyponitrite peut agir comme un agent réducteur, par exemple en réduisant l' iode :
-
N
2 O 2−
2 + 3 I
2 + 3 H
2 O → NON -
3 + NON -
2 + 6 HI
Esters d'hyponitrite
Les trans -hyponitrites organiques R 1 −O − N = N − O − R 2 peuvent être obtenus en faisant réagir l' hyponitrite Ag d' argent trans (I)
2 N
2 O
2 avec divers halogénures d'alkyle . Par exemple, la réaction avec le chlorure de t- butyle donne du trans di- tert- butyl hyponitrite.
D'autres radicaux alkyle rapportés dans la littérature comprennent l' éthyle et le benzyle . Ces composés peuvent être une source de radicaux alcoxyle .
Voir également
D'autres oxoanions d' azote comprennent
-
nitrate , NON -
3 -
nitrite , NON -
2 - peroxonitrite , (peroxynitrite), OONO -
-
peroxonitrate , HNO -
4 - trioxodinitrate , (hyponitrate), [ON = NO 2 ] 2−
- nitroxylate , [O 2 N − NO 2 ] 4−
-
orthonitrate , NON 3−
4 - dinitramide , [O 2 N − N − NO 2 ] -
- hyponitrite de nitrosyle , [ONNONO] -