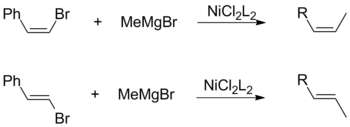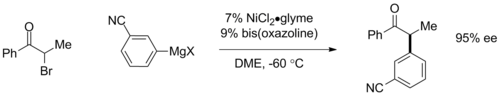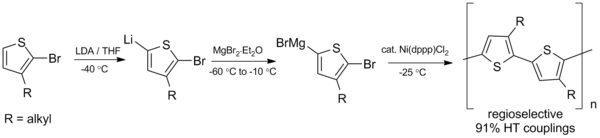Accouplement Kumada - Kumada coupling
| Accouplement Kumada | |
|---|---|
| Nommé après | Makoto Kumada |
| Type de réaction | Réaction de couplage |
| Identifiants | |
| Portail de la chimie organique | couplage kumada |
| ID d'ontologie RSC | RXNO: 0000144 |
En chimie organique , le couplage Kumada est un type de réaction de couplage croisé , utile pour générer des liaisons carbone-carbone par la réaction d'un réactif de Grignard et d'un halogénure organique. La procédure utilise des catalyseurs de métaux de transition , généralement du nickel ou du palladium, pour coupler une combinaison de deux groupes alkyle , aryle ou vinyle . Les groupes de Robert Corriu et Makoto Kumada ont rapporté la réaction indépendamment en 1972.
La réaction est remarquable pour être parmi les premières méthodes de couplage croisé catalytique rapportées. Malgré le développement ultérieur de réactions alternatives ( Suzuki , Sonogashira , Stille , Hiyama , Negishi ), le couplage Kumada continue d'être utilisé dans de nombreuses applications synthétiques , y compris la production à l'échelle industrielle d' aliskiren , un médicament contre l' hypertension , et des polythiophènes , utiles en bio appareils électroniques.
Histoire
Les premières recherches sur le couplage catalytique de réactifs de Grignard avec des halogénures organiques remontent à l'étude de 1941 des catalyseurs au cobalt par Karasch et Fields. En 1971, Tamura et Kochi ont développé ces travaux dans une série de publications démontrant la viabilité des catalyseurs à base d'argent, de cuivre et de fer. Cependant, ces premières approches ont produit de mauvais rendements en raison de la formation substantielle de produits d'homocouplage, où deux espèces identiques sont couplées.
Ces efforts ont culminé en 1972, lorsque les groupes Corriu et Kumada ont signalé simultanément l'utilisation de catalyseurs contenant du nickel. Avec l'introduction des catalyseurs au palladium en 1975 par le groupe Murahashi, la portée de la réaction s'est encore élargie. Par la suite, de nombreuses techniques de couplage supplémentaires ont été développées, aboutissant au prix Nobel de chimie 2010 récompensé par Ei-ichi Negishi , Akira Suzuki et Richard F. Heck pour leurs contributions dans ce domaine.
Mécanisme
Catalyse au palladium
Selon le mécanisme largement accepté, le couplage de Kumada catalysé au palladium est compris comme étant analogue au rôle du palladium dans d'autres réactions de couplage croisé. Le cycle catalytique proposé implique à la fois des états d'oxydation du palladium (0) et du palladium (II). Initialement, le catalyseur Pd (0) riche en électrons ( 1 ) s'insère dans la liaison R – X de l'halogénure organique. Cette addition oxydante forme un complexe organo-Pd (II) ( 2 ). Une transmétalisation ultérieure avec le réactif de Grignard forme un complexe hétéro-organométallique ( 3 ). Avant l'étape suivante, une isomérisation est nécessaire pour amener les ligands organiques les uns à côté des autres dans des positions mutuellement cis. Enfin, l'élimination réductrice de ( 4 ) forme une liaison carbone-carbone et libère le produit couplé croisé tout en régénérant le catalyseur Pd (0) ( 1 ). Pour les catalyseurs au palladium, l'addition oxydante qui détermine fréquemment la vitesse se produit plus lentement qu'avec les systèmes de catalyseurs au nickel.
Catalyse au nickel
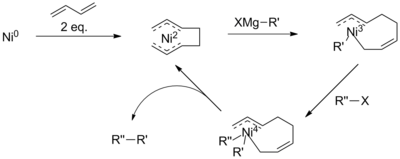
La compréhension actuelle du mécanisme du couplage catalysé par le nickel est limitée. En effet, on pense que le mécanisme de réaction se déroule différemment dans différentes conditions de réaction et lors de l'utilisation de différents ligands de nickel. En général, le mécanisme peut encore être décrit comme analogue au schéma au palladium (à droite). Dans certaines conditions de réaction, cependant, le mécanisme n'explique pas toutes les observations. L'examen par Vicic et ses collègues utilisant un ligand terpyridine tridenté a identifié des intermédiaires d'un cycle catalytique Ni (II) -Ni (I) -Ni (III), suggérant un schéma plus compliqué. De plus, avec l'addition de butadiene, on pense que la réaction implique un intermédiaire Ni (IV).
Portée
Halogénures et pseudohalogénures organiques
Le couplage Kumada a été démontré avec succès pour une variété d'halogénures d'aryle ou de vinyle. A la place du réactif halogénure, des pseudohalogénures peuvent également être utilisés, et le couplage s'est avéré assez efficace en utilisant des espèces tosylate et triflate dans diverses conditions.
Malgré un large succès avec les couplages aryle et vinyle, l'utilisation d'halogénures d'alkyle est moins générale en raison de plusieurs facteurs de complication. N'ayant pas d'électrons n, les halogénures d'alkyle nécessitent des mécanismes d'addition oxydante différents de ceux des groupes aryle ou vinyle, et ces processus sont actuellement mal compris. De plus, la présence de β-hydrogènes rend les halogénures d'alkyle sensibles aux processus d' élimination compétitifs .
Ces problèmes ont été contournés par la présence d'un groupe activateur, tel que le carbonyle dans les α-bromocétones, qui fait avancer la réaction. Cependant, des couplages Kumada ont également été réalisés avec des chaînes alkyle non activées, souvent par l'utilisation de catalyseurs ou réactifs supplémentaires. Par exemple, avec l'ajout de 1,3-butadiènes, Kambe et ses collègues ont démontré des couplages alkyl-alkyle catalysés au nickel qui, autrement, ne seraient pas réactifs.
Bien que mal compris, le mécanisme de cette réaction est proposé comme impliquant la formation d'un complexe octadiényl nickel. Il est proposé que ce catalyseur subisse d'abord une transmétalisation avec un réactif de Grignard, avant l'élimination réductrice de l'halogénure, réduisant le risque d'élimination du β-hydrure. Cependant, la présence d'un intermédiaire Ni (IV) est contraire aux mécanismes proposés pour les couplages aryle ou halogénure de vinyle.
Réactif de Grignard
Des couplages impliquant des réactifs de Grignard aryle et vinyle ont été rapportés dans les publications originales de Kumada et Corriu. Les réactifs Alkyl Grignard peuvent également être utilisés sans difficulté, car ils ne souffrent pas de processus d'élimination des β-hydrures. Bien que le réactif de Grignard ait intrinsèquement une faible tolérance aux groupes fonctionnels, des synthèses à basse température ont été préparées avec des groupes aryle hautement fonctionnalisés.
Catalyseurs
Les couplages Kumada peuvent être réalisés avec une variété de catalyseurs au nickel (II) ou au palladium (II). Les structures des précurseurs catalytiques peuvent être généralement formulées sous la forme ML 2 X 2 , où L est un ligand phosphine. Les choix courants pour L 2 comprennent les ligands diphosphine bidentés tels que dppe et dppp, entre autres.
Les travaux de Fürstner et de ses collègues sur les catalyseurs à base de fer ont montré des rendements raisonnables. L'espèce catalytique dans ces réactions est proposée comme étant un "réactif inorganique de Grignard" constitué de Fe (MgX)
2 .
Conditions de réaction
La réaction est typiquement effectuée dans du tétrahydrofurane ou de l'éther diéthylique en tant que solvant. De tels solvants éthérés sont pratiques car ce sont des solvants typiques pour générer le réactif de Grignard. En raison de la réactivité élevée du réactif de Grignard, les couplages Kumada ont une tolérance de groupe fonctionnel limitée qui peut être problématique dans les grandes synthèses. En particulier, les réactifs de Grignard sont sensibles à la protonolyse à partir de groupes même légèrement acides tels que les alcools . Ils s'ajoutent également aux carbonyles et à d'autres groupes oxydants.
Comme dans de nombreuses réactions de couplage, le catalyseur de métal de transition au palladium est souvent sensible à l'air, nécessitant un environnement de réaction inerte à l'argon ou à l'azote.
Un échantillon de préparation synthétique est disponible sur le site Web de Synthèses organiques .
Sélectivité
Stéréosélectivité
Les halogénures de cis et de trans- oléfines favorisent la rétention globale de la configuration géométrique lorsqu'ils sont couplés à des alkyl Grignards. Cette observation est indépendante d'autres facteurs, notamment le choix des ligands de catalyseur et des substituants vinyliques.
Inversement, un couplage Kumada utilisant des réactifs vinyliques de Grignard se déroule sans stéréospécificité pour former un mélange de cis et de transalcènes . Le degré d'isomérisation dépend de divers facteurs, y compris les rapports des réactifs et l'identité du groupe halogénure. Selon Kumada, cette perte de stéréochimie est attribuable à des réactions secondaires entre deux équivalents du réactif allylique de Grignard.
Énantiosélectivité
Des couplages Kumada asymétriques peuvent être effectués grâce à l'utilisation de ligands chiraux . En utilisant des ligands ferrocènes chiraux plans , des excès énantiomères (ee) de plus de 95% ont été observés dans les couplages aryle. Plus récemment, Gregory Fu et ses collègues ont démontré des couplages énantioconvergents d'a-bromocétones en utilisant des catalyseurs à base de ligands bis-oxazoline, dans lesquels le catalyseur chiral convertit un mélange racémique de matière de départ en un énantiomère de produit avec jusqu'à 95% d'ee. Cette dernière réaction est également significative pour impliquer un couplage halogénure d'alkyle traditionnellement inaccessible.
Chimiosélectivité
Les réactifs de Grignard ne se couplent généralement pas avec les arènes chlorés. Cette faible réactivité est à la base de la chimiosélectivité pour l'insertion du nickel dans la liaison C – Br du bromochlorobenzène à l'aide d'un catalyseur à base de NiCl 2 .
Applications
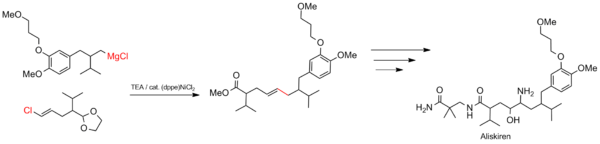
Synthèse de l'aliskiren
Le couplage Kumada convient aux processus industriels à grande échelle, tels que la synthèse de médicaments. La réaction est utilisée pour construire le squelette carboné de l' aliskiren (nom commercial Tekturna), un traitement de l' hypertension .
Synthèse des polythiophènes
Le couplage Kumada est également prometteur dans la synthèse de polymères conjugués , des polymères tels que les polyalkylthiophènes (PAT), qui ont une variété d'applications potentielles dans les cellules solaires organiques et les diodes électroluminescentes . En 1992, McCollough et Lowe ont développé la première synthèse de polyalkylthiophènes régiorégulaires en utilisant le schéma de couplage Kumada illustré ci-dessous, qui nécessite des températures inférieures à zéro.
Depuis cette préparation initiale, la synthèse a été améliorée pour obtenir des rendements plus élevés et opérer à température ambiante.
Voir également
- Heck réaction
- Accouplement Hiyama
- Réaction de Suzuki
- Accouplement Negishi
- Réaction de Petasis
- Réaction de Stille
- Couplage Sonogashira