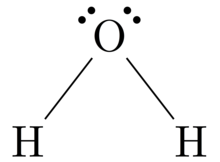
Structure de Lewis - Lewis structure
Structures de Lewis , également connu sous le nom de Lewis dot formules, Lewis dot structures , électrons parsèment structures ou de Lewis structures électrons point (LED) , sont des diagrammes qui montrent la liaison entre atomes d'une molécule , de même que les paires libres d' électrons qui peuvent exister dans la molécule. Une structure de Lewis peut être dessinée pour toute molécule liée de manière covalente , ainsi que pour les composés de coordination . La structure de Lewis a été nommée d'après Gilbert N. Lewis , qui l'a introduite dans son article de 1916 L'atome et la molécule. Les structures de Lewis étendent le concept du diagramme de points d'électrons en ajoutant des lignes entre les atomes pour représenter des paires partagées dans une liaison chimique.
Les structures de Lewis montrent chaque atome et sa position dans la structure de la molécule en utilisant son symbole chimique. Des lignes sont tracées entre les atomes qui sont liés les uns aux autres (des paires de points peuvent être utilisées à la place des lignes). Les électrons en excès qui forment des paires isolées sont représentés par des paires de points et sont placés à côté des atomes.
Bien que les principaux éléments du groupe de la deuxième période et au-delà réagissent généralement en gagnant, en perdant ou en partageant des électrons jusqu'à ce qu'ils aient atteint une configuration électronique de couche de valence avec un octet complet de (8) électrons, l'hydrogène (H) ne peut former que des liaisons qui partagent juste deux électrons.
Construction et comptage d'électrons
Le nombre total d'électrons représentés dans une structure de Lewis est égal à la somme des nombres d' électrons de valence sur chaque atome individuel. Les électrons de non-valence ne sont pas représentés dans les structures de Lewis.
Une fois le nombre total d'électrons disponibles déterminé, les électrons doivent être placés dans la structure selon ces étapes :
- Les atomes sont d'abord reliés par des liaisons simples.
- Si t est le nombre total d'électrons et n le nombre de liaisons simples, t-2n électrons restent à placer. Ceux-ci doivent être placés en paires isolées : une paire de points pour chaque paire d'électrons disponibles. Les paires isolées doivent initialement être placées sur les atomes externes (autres que l'hydrogène) jusqu'à ce que chaque atome externe ait huit électrons dans les paires de liaison et les paires isolées ; des paires isolées supplémentaires peuvent alors être placées sur l'atome central. En cas de doute, les paires isolées doivent d'abord être placées sur les atomes les plus électronégatifs.
- Une fois que toutes les paires isolées sont placées, les atomes (en particulier les atomes centraux) peuvent ne pas avoir d'octet d'électrons. Dans ce cas, les atomes doivent former une double liaison ; une seule paire d'électrons est déplacée pour former une seconde liaison entre les deux atomes. Comme la paire de liaison est partagée entre les deux atomes, l'atome qui avait à l'origine la paire isolée a toujours un octet ; l'autre atome a maintenant deux autres électrons dans sa couche de valence.
Les structures de Lewis pour les ions polyatomiques peuvent être dessinées par la même méthode. Lors du comptage des électrons, les ions négatifs doivent avoir des électrons supplémentaires placés dans leurs structures de Lewis ; les ions positifs devraient avoir moins d'électrons qu'une molécule non chargée. Lorsque la structure de Lewis d'un ion est écrite, la structure entière est placée entre parenthèses et la charge est écrite en exposant en haut à droite, en dehors des parenthèses.
Une méthode plus simple a été proposée pour construire des structures de Lewis, éliminant le besoin de comptage d'électrons : les atomes sont dessinés en montrant les électrons de valence ; les liaisons sont ensuite formées en associant les électrons de valence des atomes impliqués dans le processus de création de liaisons, et les anions et les cations sont formés en ajoutant ou en retirant des électrons aux/des atomes appropriés.
Une astuce consiste à compter les électrons de valence, puis à compter le nombre d'électrons nécessaires pour compléter la règle de l'octet (ou avec de l'hydrogène seulement 2 électrons), puis à faire la différence de ces deux nombres. La réponse est le nombre d'électrons qui composent les liaisons. Le reste des électrons va juste remplir tous les octets des autres atomes.
Une autre procédure simple et générale pour écrire des structures de Lewis et des formes de résonance a été proposée.
Charge formelle
En termes de structures de Lewis, la charge formelle est utilisée dans la description, la comparaison et l'évaluation des structures topologiques et de résonance probables en déterminant la charge électronique apparente de chaque atome à l'intérieur, en fonction de sa structure de points d'électrons, en supposant une covalence exclusive ou une liaison non polaire. . Il a des utilisations pour déterminer la reconfiguration électronique possible en se référant aux mécanismes de réaction , et aboutit souvent au même signe que la charge partielle de l'atome, à quelques exceptions près. En général, la charge formelle d'un atome peut être calculée à l'aide de la formule suivante, en supposant des définitions non standard pour le balisage utilisé :
où:
- est la charge formelle.
- représente le nombre d'électrons de valence dans un atome libre de l'élément.
- représente le nombre d'électrons non partagés sur l'atome.
- représente le nombre total d'électrons dans les liaisons que l'atome a avec un autre.
La charge formelle d'un atome est calculée comme la différence entre le nombre d'électrons de valence qu'aurait un atome neutre et le nombre d'électrons qui lui appartiennent dans la structure de Lewis. Les électrons dans les liaisons covalentes sont répartis également entre les atomes impliqués dans la liaison. Le total des charges formelles sur un ion doit être égal à la charge sur l'ion, et le total des charges formelles sur une molécule neutre doit être égal à zéro.
Résonance
Pour certaines molécules et certains ions, il est difficile de déterminer quelles paires isolées doivent être déplacées pour former des liaisons doubles ou triples, et deux ou plusieurs structures de résonance différentes peuvent être écrites pour la même molécule ou le même ion. Dans de tels cas, il est habituel de les écrire tous avec des flèches bidirectionnelles entre les deux (voir l'exemple ci-dessous). C'est parfois le cas lorsque plusieurs atomes du même type entourent l'atome central, et c'est particulièrement fréquent pour les ions polyatomiques.
Lorsque cette situation se produit, la structure de Lewis de la molécule est dite structure de résonance et la molécule existe en tant qu'hybride de résonance. Chacune des différentes possibilités se superpose aux autres, et la molécule est considérée comme ayant une structure de Lewis équivalente à une combinaison de ces états.
L'ion nitrate (NO 3 − ), par exemple, doit former une double liaison entre l'azote et l'un des oxygènes pour satisfaire à la règle de l'octet pour l'azote. Cependant, comme la molécule est symétrique, peu importe lequel des oxygènes forme la double liaison. Dans ce cas, il existe trois structures de résonance possibles. L'expression de la résonance lors du dessin des structures de Lewis peut être effectuée soit en dessinant chacune des formes de résonance possibles et en plaçant des flèches à double tête entre elles, soit en utilisant des lignes pointillées pour représenter les liaisons partielles (bien que cette dernière soit une bonne représentation de l'hybride de résonance qui est pas, formellement parlant, une structure de Lewis).
Lorsque l'on compare les structures de résonance pour la même molécule, généralement celles avec le moins de charges formelles contribuent davantage à l'hybride de résonance global. Lorsque des charges formelles sont nécessaires, les structures de résonance qui ont des charges négatives sur les éléments les plus électronégatifs et des charges positives sur les éléments les moins électronégatifs sont favorisées.
Les liaisons simples peuvent également être déplacées de la même manière pour créer des structures de résonance pour des molécules hypervalentes telles que l'hexafluorure de soufre , qui est la description correcte selon les calculs de chimie quantique au lieu du modèle d'octet étendu commun.
La structure de résonance ne doit pas être interprétée comme indiquant que la molécule passe d'une forme à l'autre, mais que la molécule agit comme la moyenne de plusieurs formes.
Exemple
La formule de l' ion nitrite est NO−
2.
- L'azote est l'atome le moins électronégatif des deux, c'est donc l'atome central selon de multiples critères.
- Compter les électrons de valence. L'azote a 5 électrons de valence; chaque oxygène en a 6, pour un total de (6 × 2) + 5 = 17. L'ion a une charge de -1, ce qui indique un électron supplémentaire, donc le nombre total d'électrons est de 18.
- Reliez les atomes par des liaisons simples. Chaque oxygène doit être lié à l'azote, qui utilise quatre électrons, deux dans chaque liaison.
- Placez des paires isolées. Les 14 électrons restants doivent initialement être placés sous forme de 7 paires isolées. Chaque oxygène peut prendre un maximum de 3 paires isolées, donnant à chaque oxygène 8 électrons, y compris la paire de liaison. La septième paire isolée doit être placée sur l'atome d'azote.
- Satisfaire à la règle de l'octet. Les deux atomes d'oxygène ont actuellement 8 électrons qui leur sont attribués. L'atome d'azote n'a que 6 électrons qui lui sont assignés. L'une des paires isolées sur un atome d'oxygène doit former une double liaison, mais l'un ou l'autre atome fonctionnera aussi bien. Il y a donc une structure de résonance.
- Attacher les extrémités libres. Deux structures de Lewis doivent être dessinées : Chaque structure a un des deux atomes d'oxygène doublement lié à l'atome d'azote. Le deuxième atome d'oxygène dans chaque structure sera uni à l'atome d'azote. Placez des parenthèses autour de chaque structure et ajoutez la charge (−) en haut à droite à l'extérieur des parenthèses. Tracez une flèche à double tête entre les deux formes de résonance.
Formations alternatives

Les structures chimiques peuvent être écrites sous des formes plus compactes, en particulier lorsqu'elles montrent des molécules organiques . Dans les formules structurelles condensées, plusieurs ou même toutes les liaisons covalentes peuvent être omises, avec des indices indiquant le nombre de groupes identiques attachés à un atome particulier. Un autre diagramme structurel abrégé est la formule squelettique (également connue sous le nom de formule de ligne de liaison ou de diagramme de squelette de carbone). Dans une formule squelettique, les atomes de carbone ne sont pas signifiés par le symbole C mais par les sommets des lignes. Les atomes d'hydrogène liés au carbone ne sont pas représentés - ils peuvent être déduits en comptant le nombre de liaisons à un atome de carbone particulier - chaque carbone est supposé avoir quatre liaisons au total, de sorte que toutes les liaisons non représentées sont, par implication, des atomes d'hydrogène.
D'autres diagrammes peuvent être plus complexes que les structures de Lewis, montrant des liaisons en 3D en utilisant diverses formes telles que des diagrammes de remplissage d'espace .
Utilisation et limites
Malgré leur simplicité et leur développement au début du XXe siècle, lorsque la compréhension de la liaison chimique était encore rudimentaire, les structures de Lewis capturent bon nombre des caractéristiques clés de la structure électronique d'une gamme de systèmes moléculaires, y compris celles pertinentes pour la réactivité chimique. Ainsi, ils continuent d'être largement utilisés par les chimistes et les professeurs de chimie. Cela est particulièrement vrai dans le domaine de la chimie organique , où le modèle traditionnel de liaison de valence domine toujours et où les mécanismes sont souvent compris en termes de notation courbe-flèche superposée à des formules squelettiques , qui sont des versions abrégées des structures de Lewis. En raison de la plus grande variété de schémas de liaison rencontrés en chimie inorganique et organométallique , de nombreuses molécules rencontrées nécessitent l'utilisation d' orbitales moléculaires entièrement délocalisées pour décrire de manière adéquate leur liaison, ce qui rend les structures de Lewis relativement moins importantes (bien qu'elles soient encore courantes).
Il est important de noter qu'il existe des systèmes moléculaires simples et archétypaux pour lesquels une description de Lewis, au moins sous une forme non modifiée, est trompeuse ou inexacte. Notamment, le dessin naïf des structures de Lewis pour les molécules connues expérimentalement pour contenir des électrons non appariés (par exemple, O 2 , NO et ClO 2 ) conduit à des inférences incorrectes des ordres de liaison, des longueurs de liaison et/ou des propriétés magnétiques. Un modèle de Lewis simple ne tient pas non plus compte du phénomène d' aromaticité . Par exemple, les structures de Lewis n'expliquent pas pourquoi le C 6 H 6 cyclique (benzène) subit une stabilisation spéciale au-delà des effets de délocalisation normaux, tandis que le C 4 H 4 (cyclobutadiène) subit en fait une déstabilisation spéciale . La théorie des orbitales moléculaires fournit l'explication la plus simple de ces phénomènes.
Voir également
- Théorie de la répulsion des paires d'électrons de la couche de Valence
- Géométrie moléculaire
- Formule structurelle
- Orbital de liaison naturelle