Myosine-chaîne légère phosphatase - Myosin-light-chain phosphatase
| Phosphatase à chaîne légère de myosine | |||||||||
|---|---|---|---|---|---|---|---|---|---|
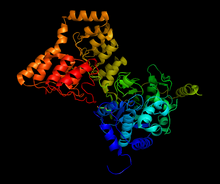 Structure du complexe entre PP1 et une portion de MYPT1, généré à partir de 1s70
| |||||||||
| Identifiants | |||||||||
| CE n° | 3.1.3.53 | ||||||||
| N ° CAS. | 86417-96-1 | ||||||||
| Bases de données | |||||||||
| IntEnz | Vue IntEnz | ||||||||
| BRENDA | Entrée BRENDA | ||||||||
| ExPASy | Vue NiceZyme | ||||||||
| KEGG | Entrée KEGG | ||||||||
| MétaCycle | voie métabolique | ||||||||
| PRIAM | profil | ||||||||
| Structures de l' APB | RCSB PDB PDBe PDBsum | ||||||||
| Ontologie des gènes | AmiGO / QuickGO | ||||||||
| |||||||||
La myosine phosphatase à chaîne légère , plus communément appelée myosine phosphatase ( EC 3.1.3.53 ) , est une enzyme ( en particulier une protéine phosphatase spécifique à la sérine/thréonine ) qui déphosphoryle la chaîne légère régulatrice de la myosine II . Cette réaction de déphosphorylation se produit dans le tissu musculaire lisse et initie le processus de relaxation des cellules musculaires. Ainsi, la myosine phosphatase annule le processus de contraction musculaire initié par la myosine kinase à chaîne légère . L'enzyme est composée de trois sous-unités : la région catalytique ( protéine phosphatase 1 ou PP1), la sous-unité de liaison à la myosine (MYPT1) et une troisième sous-unité (M20) de fonction inconnue. La région catalytique utilise deux ions manganèse comme catalyseurs pour déphosphoryler les chaînes légères sur la myosine, ce qui provoque un changement de conformation de la myosine et détend le muscle. L'enzyme est hautement conservée et se trouve dans le tissu musculaire lisse de tous les organismes. Bien que l'on sache que la myosine phosphatase est régulée par les protéines kinases rho-associées , il existe actuellement un débat sur la question de savoir si d'autres molécules, telles que l'acide arachidonique et l' AMPc , régulent également l'enzyme.
Fonction
Le tissu musculaire lisse est principalement constitué d' actine et de myosine, deux protéines qui interagissent pour produire la contraction et la relaxation musculaire. La myosine II, également connue sous le nom de myosine conventionnelle, possède deux chaînes lourdes constituées des domaines tête et queue et quatre chaînes légères (deux par tête) qui se lient aux chaînes lourdes dans la région du «cou». Lorsque le muscle a besoin de se contracter, les ions calcium pénètrent dans le cytosol depuis le réticulum sarcoplasmique , où ils activent la calmoduline, qui à son tour active la kinase à chaîne légère de la myosine (MLC kinase). La MLC kinase phosphoryle la chaîne légère de myosine (MLC 20 ) au niveau du résidu Ser-19. Cette phosphorylation provoque un changement de conformation de la myosine, activant le cycle crossbridge et provoquant la contraction du muscle. Parce que la myosine subit un changement de conformation, le muscle restera contracté même si les concentrations de calcium et de kinase MLC activée sont ramenées à des niveaux normaux. Le changement de conformation doit être annulé pour détendre le muscle.
Lorsque la myosine phosphatase se lie à la myosine, elle supprime le groupe phosphate . Sans le groupe, la myosine revient à sa conformation d'origine, dans laquelle elle ne peut pas interagir avec l'actine et maintenir le muscle tendu, de sorte que le muscle se détend. Le muscle restera dans cette position détendue jusqu'à ce que la myosine soit phosphorylée par la MLC kinase et subisse un changement de conformation.
Structure
La myosine phosphatase est constituée de trois sous-unités. La sous-unité catalytique, PP1, est l'une des phosphatases Ser/Thr les plus importantes dans les cellules eucaryotes , car elle joue un rôle dans le métabolisme du glycogène , le transport intracellulaire, la synthèse des protéines et la division cellulaire ainsi que la contraction des muscles lisses. Parce qu'il est si important pour les fonctions cellulaires de base, et parce qu'il y a beaucoup moins de protéines phosphatases que de kinases dans les cellules, la structure et la fonction de PP1 sont hautement conservées (bien que l'isoforme spécifique utilisée dans la myosine phosphatase soit l'isoforme , PP1δ). PP1 fonctionne en utilisant deux ions manganèse comme catalyseurs pour la déphosphorylation (voir ci-dessous).
Autour de ces ions se trouve une fente en forme de Y avec trois rainures : une hydrophobe, une acide et une rainure C-terminale. Lorsque PP1 n'est lié à aucune autre sous-unité, il n'est pas particulièrement spécifique. Cependant, lorsqu'elle se lie à la deuxième sous-unité de la myosine phosphatase, MYPT1 (MW ~ 130 kDa), cette fente catalytique change de configuration. Il en résulte une augmentation spectaculaire de la spécificité de la myosine. Ainsi, il est clair que MYPT1 a un grand pouvoir régulateur sur PP1 et la myosine phosphatase, même sans la présence d'autres activateurs ou inhibiteurs.
La troisième sous-unité, M20 (à ne pas confondre avec MLC 20 , la sous-unité régulatrice critique de la myosine), est la sous-unité la plus petite et la plus mystérieuse. Actuellement, on sait peu de choses sur le M20, sauf qu'il n'est pas nécessaire pour la catalyse, car le retrait de la sous-unité n'affecte pas le renouvellement ou la sélectivité. Alors que certains pensent qu'il pourrait avoir une fonction réglementaire, rien n'a encore été déterminé.
Mécanisme
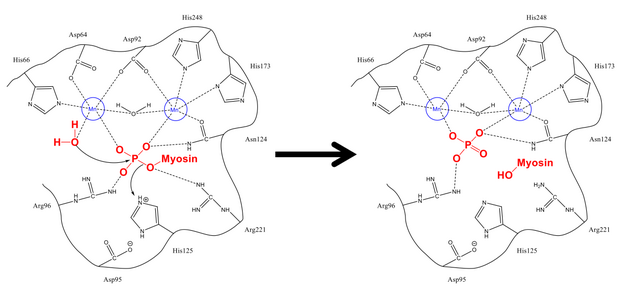
Le mécanisme d'élimination du phosphate de Ser-19 est très similaire à d'autres réactions de déphosphorylation dans la cellule, telles que l'activation de la glycogène synthase . La sous-unité régulatrice de la myosine MLC 20 se lie à la fois aux sillons hydrophobes et acides de PP1 et MYPT1, le site régulateur de la myosine phosphatase. Une fois dans la configuration appropriée, la sérine phyosphorylée et une molécule d'eau libre sont stabilisées par les résidus de liaison hydrogène dans le site actif, ainsi que par les ions chargés positivement (qui interagissent fortement avec le groupe phosphate négatif). His-125 (sur la myosine phosphatase) donne un proton à Ser-19 MLC 20 ), et la molécule d'eau attaque l' atome de phosphore . Après avoir mélangé les protons pour se stabiliser (ce qui se produit rapidement par rapport à l'attaque du phosphore), le phosphate et l'alcool se forment et tous deux quittent le site actif.
Réglementation et santé humaine
Les voies de régulation de la MLC kinase ont été bien établies, mais jusqu'à la fin des années 1980, on supposait que la myosine phosphatase n'était pas régulée et que la contraction/relaxation dépendait entièrement de l'activité de la MLC kinase. Cependant, depuis les années 1980, l'effet inhibiteur de la protéine kinase rho-associée a été découvert et étudié de manière approfondie. RhoA GTP active la Rho-kinase , qui phosphoryle le MYPT1 sur deux sites inhibiteurs majeurs, Thr-696 et Thr-866. Cela démontre pleinement la valeur du MYPT1, non seulement pour augmenter la vitesse et la spécificité de la réaction, mais aussi pour ralentir considérablement la réaction. Cependant, lorsque la télokine est ajoutée, elle annule efficacement l'effet de la Rho-kinase, même si elle ne déphosphoryle pas MYPT1.
Une autre stratégie réglementaire proposée implique l'acide arachidonique. Lorsque l'acide arachidonique est ajouté au tissu musculaire tendu, l'acide diminue le taux de déphosphorylation (et donc de relaxation) de la myosine. Cependant, on ne sait pas comment l'acide arachidonique fonctionne en tant qu'inhibiteur . Deux théories concurrentes sont que soit l'acide arachidonique agit comme un co-messager dans la cascade rho-kinase mentionnée ci-dessus, soit qu'il se lie à l'extrémité c-terminale de MYPT1.
Lorsque les systèmes de régulation de la myosine phosphatase commencent à défaillir, il peut y avoir des conséquences majeures sur la santé. Étant donné que le muscle lisse se trouve dans les systèmes respiratoire, circulatoire et la reproduction de l' homme (ainsi que d' autres lieux), si le muscle lisse peut pas se détendre plus longtemps en raison de la réglementation défectueuse, alors un grand nombre de problèmes allant de l' asthme , l' hypertension , et une dysfonction érectile peut en résulter.
Voir également
Les références
Lectures complémentaires
- Pato MD, Adelstein RS (1983). "Purification et caractérisation d'une phosphatase multi-sous-unité du muscle lisse du gésier de dinde. L'effet de la liaison de la calmoduline à la kinase de la chaîne légère de la myosine sur la déphosphorylation" . J. Biol. Chem . 258 (11) : 7047-54. doi : 10.1016/S0021-9258 (18) 32330-5 . PMID 6304072 .
- Kimura K ; et al. (1996). « Régulation de la myosine phosphatase par Rho et Rho-associated kinase (Rho-kinase) ». Sciences . 273 (5272) : 245-248. Bibcode : 1996Sci ... 273..245K . doi : 10.1126/science.273.5272.245 . PMID 8662509 . S2CID 37249779 .