Peroxydicarbonate - Peroxydicarbonate
En chimie , le peroxydicarbonate (parfois peroxodicarbonate ) est un anion divalent de formule C
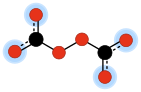
2O2−
6. C'est l'un des anions oxocarbonés , qui se composent uniquement de carbone et d' oxygène . Sa structure moléculaire peut être considérée comme deux anions carbonates joints de manière à former un pont peroxyde –O–O–.
L'anion est formé, avec le peroxocarbonate CO2−
4, à l' électrode négative lors de l' électrolyse du carbonate de lithium fondu . L'anion peut également être obtenu par électrolyse d'une solution saturée de carbonate de rubidium dans l'eau.
De plus, l'anion peroxodicarbonate peut être obtenu par électrosynthèse sur des électrodes en diamant dopé au bore (BDD). L' oxydation formelle de deux ions carbonate a lieu à l'anode. En raison du potentiel d'oxydation élevé de l'anion peroxodicarbonate, une surtension anodique élevée est nécessaire. Ceci est encore plus important si des radicaux hydroxyles sont impliqués dans le processus de formation. Des publications récentes montrent qu'une concentration de 282 mmol/l de peroxodicarbonate peut être atteinte dans une cellule non divisée avec du carbonate de sodium comme matière première à des densités de courant de 720 mA/cm². Le procédé décrit convient à la production à l'échelle pilote de peroxodicarbonate de sodium.
Le peroxydicarbonate de potassium K 2 C 2 O 6 a été obtenu par Constam et von Hansen en 1895 ; sa structure cristalline n'a été déterminée qu'en 2002. Elle aussi peut être obtenue par électrolyse d'une solution saturée de carbonate de potassium à −20 °C. C'est un solide cristallin bleu clair qui se décompose à 141 °C, libérant de l' oxygène et du dioxyde de carbone, et se décompose lentement à des températures plus basses.
Le peroxodicarbonate de rubidium est un solide cristallin bleu clair qui se décompose à 424 K (151 °C). Sa structure a été publiée en 2003. Dans les deux sels, chacune des deux unités carbonatées est plane. Dans le sel de rubidium, la molécule entière est plane, tandis que dans le sel de potassium, les deux unités se trouvent sur des plans différents et presque perpendiculaires, qui contiennent tous deux la liaison O–O.
Voir également
Les références