Phénylalanine hydroxylase - Phenylalanine hydroxylase
La phénylalanine hydroxylase ( HAP ) ( EC 1.14.16.1 ) est une enzyme qui catalyse l' hydroxylation de la chaîne latérale aromatique de la phénylalanine pour générer de la tyrosine . L'HAP est l'un des trois membres des hydroxylases d' acides aminés aromatiques dépendantes de la bioptérine , une classe de monooxygénase qui utilise la tétrahydrobioptérine (BH 4 , un cofacteur de la ptéridine ) et un fer non hémique pour la catalyse. Au cours de la réaction, l'oxygène moléculaire est clivé par hétérolyse avec incorporation séquentielle d'un atome d'oxygène dans le BH 4 et le substrat de phénylalanine. Chez l'homme, des mutations de son gène codant, la PAH , peuvent entraîner le trouble métabolique phénylcétonurie .
Mécanisme enzymatique
On pense que la réaction se déroule selon les étapes suivantes :
- formation d'un pont Fe(II)-OO-BH 4 .
- clivage hétérolytique de la liaison OO pour donner l'intermédiaire d'hydroxylation ferryl oxo Fe(IV)=O
- attaque sur Fe(IV)=O pour hydroxyler le substrat de phénylalanine en tyrosine.
Formation et clivage du pont fer-peroxyptérine. Bien que les preuves soutiennent fortement Fe(IV)=O comme intermédiaire d'hydroxylation, les détails mécanistiques sous-jacents à la formation du pont Fe(II)-OO-BH 4 avant le clivage hétérolytique restent controversés. Deux voies ont été proposées sur la base de modèles qui diffèrent par la proximité du fer au cofacteur ptérine et le nombre de molécules d'eau supposées être coordonnées par le fer au cours de la catalyse. Selon un modèle, un complexe fer-dioxygène est initialement formé et stabilisé en tant qu'hybride de résonance de Fe 2+ O 2 et Fe 3+ O 2 − . L'O 2 activé attaque alors BH 4 , formant un état de transition caractérisé par une séparation de charge entre le cycle ptérine déficient en électrons et les espèces dioxygène riches en électrons. Le pont Fe(II)-OO-BH 4 est ensuite formé. D'autre part, la formation de ce pont a été modélisée en supposant que BH4 est situé dans la première couche de coordination du fer et que le fer n'est coordonné à aucune molécule d'eau. Ce modèle prédit un mécanisme différent impliquant un radical ptérine et un superoxyde comme intermédiaires critiques. Une fois formé, le pont Fe(II)-OO-BH 4 est rompu par clivage hétérolytique de la liaison OO en Fe(IV)=O et 4a-hydroxytétrahydrobioptérine ; ainsi, l'oxygène moléculaire est la source des deux atomes d'oxygène utilisés pour hydroxyler le cycle ptérine et la phénylalanine.
Hydroxylation de la phénylalanine par l'intermédiaire ferryl oxo. Étant donné que le mécanisme implique un intermédiaire d'hydroxylation Fe(IV)=O (par opposition à une peroxyptérine), l'oxydation du cofacteur BH 4 et l'hydroxylation de la phénylalanine peuvent être découplées, entraînant une consommation improductive de BH4 et la formation de H2O2. Lorsqu'il est productif, cependant, l'intermédiaire Fe(IV)=O est ajouté à la phénylalanine dans une réaction de substitution aromatique électrophile qui réduit le fer de l'état ferreux à l'état ferreux. Bien qu'initialement un oxyde d'arène ou un intermédiaire radicalaire ait été proposé, les analyses des tryptophane et tyrosine hydroxylases apparentées ont suggéré que la réaction se déroule plutôt à travers un intermédiaire cationique qui nécessite que Fe(IV)=O soit coordonné à un ligand eau plutôt qu'à un groupe hydroxo. . Cet intermédiaire cationique subit ensuite un déplacement 1,2-hydrure NIH, produisant un intermédiaire diénone qui tautomérise ensuite pour former le produit tyrosine. Le cofacteur ptérine est régénéré par hydratation du produit carbinolamine de PAH en dihydrobioptérine quinonoïde (qBH 2 ), qui est ensuite réduite en BH 4 .
Régulation enzymatique
HAP est proposé d'utiliser le morpheein modèle de régulation allostérique .
L'HAP de mammifère existe dans un équilibre constitué de tétramères de deux architectures distinctes, avec une ou plusieurs formes dimères faisant partie de l'équilibre. Ce comportement est cohérent avec un mécanisme allostérique dissociatif.
De nombreuses études suggèrent que les HAP de mammifères présentent un comportement comparable à celui de la porphobilinogène synthase (PBGS), dans lequel une variété de facteurs tels que le pH et la liaison au ligand sont signalés comme affectant l'activité enzymatique et la stabilité des protéines.
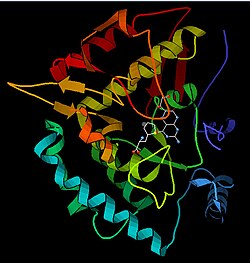
Structure
Le monomère PAH (51,9 kDa) se compose de trois domaines distincts : un domaine N-terminal régulateur (résidus 1–117) qui contient un sous-domaine ACT de liaison Phe, le domaine catalytique (résidus 118–427) et un domaine C-terminal (résidus 428-453) responsables de l'oligomérisation de monomères identiques. Une analyse cristallographique approfondie a été réalisée, en particulier sur le domaine catalytique coordonné par la ptérine et le fer pour examiner le site actif. La structure du domaine régulateur N-terminal a également été déterminée, et avec la structure résolue du domaine homologue de tétramérisation C-terminal de la tyrosine hydroxylase, un modèle structurel de l'HAP tétramère a été proposé. En utilisant la cristallographie aux rayons X, la structure de l'HAP de rat pleine longueur a été déterminée expérimentalement et a montré la forme auto-inhibée ou à l'état de repos de l'enzyme. La forme à l'état de repos (RS-PAH) est architecturalement distincte de la forme activée (A-PAH). Une structure complète de l'A-PAH fait actuellement défaut, mais l'interface ACT-ACT stabilisée par Phe qui est caractéristique de l'A-PAH a été déterminée et un modèle structurel de l'A-PAH basé sur l'analyse SAXS a été proposé.
Domaine catalytique
Les structures cristallines résolues du domaine catalytique indiquent que le site actif consiste en une poche ouverte et spacieuse bordée principalement de résidus hydrophobes, bien que trois résidus d'acide glutamique, deux histidines et une tyrosine soient également présents et se lient au fer. Des preuves contradictoires existent sur l'état de coordination de l'atome ferreux et sa proximité avec BH4 dans le site actif. Selon l'analyse cristallographique, Fe(II) est coordonné par l'eau, His285, His290 et Glu330 (un arrangement de triade faciale 2-his-1-carboxylate) avec une géométrie octaédrique. L'inclusion d'un analogue de Phe dans la structure cristalline change à la fois le fer d'un état de six à un état de cinq coordonnées impliquant une seule molécule d'eau et une coordination bidentée vers Glu330 et ouvrant un site pour la liaison de l'oxygène. BH4 est déplacé de manière concomitante vers l'atome de fer, bien que le cofacteur ptérine reste dans la deuxième sphère de coordination. D'autre part, un modèle concurrent basé sur des analyses de RMN et de modélisation moléculaire suggère que toutes les molécules d'eau coordonnées sont expulsées du site actif pendant le cycle catalytique tandis que BH4 devient directement coordonné au fer. Comme discuté ci-dessus, la résolution de cette divergence sera importante pour déterminer le mécanisme exact de la catalyse des HAP.
Domaine de régulation N-terminal
La nature régulatrice du domaine N-terminal (résidus 1-117) est conférée par sa flexibilité structurelle. L'analyse des échanges hydrogène/deutérium indique que la liaison allostérique de Phe altère globalement la conformation des HAP de sorte que le site actif est moins occlus car l'interface entre les domaines régulateur et catalytique est de plus en plus exposée au solvant. Cette observation est cohérente avec les études cinétiques, qui montrent un taux initialement faible de formation de tyrosine pour les HAP de pleine longueur. Ce temps de latence n'est cependant pas observé pour un PAH tronqué dépourvu du domaine N-terminal ou si l'enzyme pleine longueur est pré-incubée avec Phe. La suppression du domaine N-terminal élimine également le temps de latence tout en augmentant l'affinité pour Phe de près de deux fois ; aucune différence n'est observée dans le V max ou le K m pour le cofacteur tétrahydrobioptérine. Une régulation supplémentaire est fournie par Ser16 ; la phosphorylation de ce résidu n'altère pas la conformation de l'enzyme mais réduit la concentration de Phe requise pour l'activation allostérique. Ce domaine régulateur N-terminal n'est pas observé dans les HAP bactériens mais présente une homologie structurelle considérable avec le domaine régulateur de la phosphoglycérate déshydrogénase, une enzyme de la voie de biosynthèse de la sérine.
Domaine de tétramérisation
L'HAP procaryote est monomérique, tandis que l'HAP eucaryote existe dans un équilibre entre les formes homotétramères et homodimériques. L'interface de dimérisation est composée de boucles liées à la symétrie qui relient des monomères identiques, tandis que le domaine de tétramérisation C-terminal qui se chevauche médie l'association de dimères conformationnellement distincts qui sont caractérisés par une orientation relative différente des domaines catalytique et de tétramérisation (Flatmark, Erlandsen). La distorsion résultante de la symétrie du tétramère est évidente dans la surface différentielle des interfaces de dimérisation et distingue le PAH de la tyrosine hydroxylase à symétrie tétramère. Un mécanisme d'échange de domaine a été proposé pour médier la formation du tétramère à partir de dimères, dans lequel les hélices alpha C-terminales modifient mutuellement leur conformation autour d'une région charnière flexible à cinq résidus C-terminal pour former une structure en spirale, déplaçant l'équilibre vers la forme tétramérique. Bien que les formes homodimères et homotétramères de PAH soient catalytiquement actives, les deux présentent une cinétique et une régulation différentielles. En plus d'une efficacité catalytique réduite, le dimère ne présente pas de coopérativité positive envers la L-Phe (qui, à des concentrations élevées, active l'enzyme), suggérant que la L-Phe régule allostériquement les HAP en influençant l'interaction dimère-dimère.
Fonction biologique
L'HAP est une enzyme critique dans le métabolisme de la phénylalanine et catalyse l'étape limitant la vitesse de son catabolisme complet en dioxyde de carbone et en eau. La régulation du flux par les voies associées à la phénylalanine est essentielle dans le métabolisme des mammifères, comme en témoigne la toxicité des taux plasmatiques élevés de cet acide aminé observés dans la phénylcétonurie (voir ci-dessous). La principale source de phénylalanine est les protéines ingérées, mais relativement peu de ce pool est utilisé pour la synthèse des protéines. Au lieu de cela, la majorité de la phénylalanine ingérée est catabolisée par les HAP pour former la tyrosine ; l'ajout du groupe hydroxyle permet de rompre le cycle benzénique dans les étapes cataboliques ultérieures. La transamination en phénylpyruvate , dont les métabolites sont excrétés dans l'urine, représente une autre voie de renouvellement de la phénylalanine, mais le catabolisme via les HAP prédomine.
Chez l'homme, cette enzyme est exprimée à la fois dans le foie et dans les reins, et il semblerait qu'elle puisse être régulée de manière différentielle dans ces tissus. L'HAP est inhabituel parmi les hydroxylases d'acides aminés aromatiques pour son implication dans le catabolisme ; les tyrosine et tryptophane hydroxylases , d'autre part, sont principalement exprimées dans le système nerveux central et catalysent les étapes limitantes de la biosynthèse des neurotransmetteurs/hormones.
Pertinence de la maladie
Une déficience de l'activité de l'HTAP due à des mutations de l' HTAP provoque une hyperphénylalaninémie (HPA), et lorsque les taux sanguins de phénylalanine augmentent au-dessus de 20 fois la concentration normale, il en résulte une maladie métabolique, une phénylcétonurie (PCU). La PCU est à la fois génotypiquement et phénotypiquement hétérogène : plus de 300 variants pathogènes distincts ont été identifiés, dont la majorité correspondent à des mutations faux-sens qui correspondent au domaine catalytique. Lorsqu'une cohorte de mutants de PAH identifiés a été exprimé dans des systèmes recombinants, les enzymes ont affiché un comportement cinétique altéré et/ou une stabilité réduite, ce qui correspond à la cartographie structurelle de ces mutations dans les domaines catalytique et de tétramérisation de l'enzyme. Le BH4 4 a été administré en tant que traitement pharmacologique et il a été démontré qu'il réduisait les taux sanguins de phénylalanine chez un segment de patients atteints de PCU dont les génotypes entraînent une certaine activité résiduelle de l'HTAP mais n'ont aucun défaut dans la synthèse ou la régénération de BH4 4 . Des études de suivi suggèrent que dans le cas de certains mutants de PAH, un excès de BH4 4 agit comme un chaperon pharmacologique pour stabiliser les enzymes mutantes avec un assemblage tétramère perturbé et une sensibilité accrue au clivage et à l'agrégation protéolytiques. Les mutations qui ont été identifiées dans le locus PAH sont documentées dans la base de connaissances du locus phénylalanine hydroxylase (PAHdb, https://web.archive.org/web/20130718162051/http://www.pahdb.mcgill.ca/ ).
Étant donné que la phénylcétonurie peut causer des dommages irréversibles, il est impératif que les carences en phénylalanine hydroxylase soient déterminées dès le début du développement. À l'origine, cela se faisait à l'aide d'un test d'inhibition bactérienne connu sous le nom de test de Guthrie . Désormais, la PCU fait partie du dépistage néonatal dans de nombreux pays, et des taux élevés de phénylalanine sont identifiés peu de temps après la naissance par mesure par spectrométrie de masse en tandem . Placer l'individu sur un régime pauvre en phénylalanine et riche en tyrosine peut aider à prévenir tout dommage à long terme pour son développement.
Enzymes apparentées
La phénylalanine hydroxylase est étroitement liée à deux autres enzymes :
- tryptophane hydroxylase (numéro CE 1.14.16.4), qui contrôle les niveaux de sérotonine dans le cerveau et le tractus gastro-intestinal
- la tyrosine hydroxylase (numéro CE 1.14.16.2), qui contrôle les niveaux de dopamine , d' épinéphrine et de noradrénaline dans le cerveau et la médullosurrénale.
Les trois enzymes sont homologues, c'est-à-dire qu'on pense qu'elles ont évolué à partir de la même ancienne hydroxylase.
Les références
Lectures complémentaires
- Eisensmith RC, Woo SL (1993). « Base moléculaire de la phénylcétonurie et des hyperphénylalaninémies apparentées : mutations et polymorphismes dans le gène humain de la phénylalanine hydroxylase ». Mutation humaine . 1 (1) : 13-23. doi : 10.1002/humu.1380010104 . PMID 1301187 . S2CID 19476605 .
- Konecki DS, Lichter-Konecki U (août 1991). « Le locus de la phénylcétonurie : connaissances actuelles sur les allèles et les mutations du gène de la phénylalanine hydroxylase dans diverses populations ». Génétique humaine . 87 (4) : 377-88. doi : 10.1007/BF00197152 . PMID 1679029 . S2CID 25627287 .
- Coton RG (1991). « Hétérogénéité de la phénylcétonurie aux niveaux clinique, protéique et ADN ». Journal des maladies métaboliques héréditaires . 13 (5) : 739–50. doi : 10.1007/BF01799577 . PMID 2246858 . S2CID 21931016 .
- Erlandsen H, Fusetti F, Martinez A, Hough E, Flatmark T, Stevens RC (décembre 1997). « La structure cristalline du domaine catalytique de la phénylalanine hydroxylase humaine révèle la base structurelle de la phénylcétonurie ». Biologie structurale de la nature . 4 (12) : 995-1000. doi : 10.1038/nsb1297-995 . PMID 9406548 . S2CID 6293946 .
- Waters PJ, Parniak MA, Nowacki P, Scriver CR (1998). « Analyse de l'expression in vitro des mutations de la phénylalanine hydroxylase : lier le génotype au phénotype et la structure à la fonction ». Mutation humaine . 11 (1) : 4-17. doi : 10.1002/(SICI)1098-1004(1998)11:1<4::AID-HUMU2>3.0.CO;2-L . PMID 9450897 .
- Waters PJ (avril 2003). "Comment les mutations du gène PAH provoquent l'hyper-phénylalaninémie et pourquoi le mécanisme est important : aperçu de l'expression in vitro" . Mutation humaine . 21 (4) : 357-69. doi : 10.1002/humu.10197 . PMID 12655545 . S2CID 23769500 .
Liens externes
- Entrée GeneReviews/NCBI/NIH/UW sur le déficit en phénylalanine hydroxylase
- Base de données spécifique au locus des variants du gène de la phénylalanine hydroxylase humaine
- Molécule du mois : Phénylalanine hydroxylase
- Aperçu de toutes les informations structurelles disponibles dans le PDB pour UniProt : P00439 (Human Phenylalanine hydroxylase) au PDBe-KB .