Prostacycline - Prostacyclin
 | |
 | |
| Donnée clinique | |
|---|---|
| Appellations commerciales | Flolan, Veletri |
| AHFS / Drugs.com | Monographie |
| Données de licence | |
Catégorie grossesse |
|
| code ATC | |
| Statut légal | |
| Statut légal | |
| Données pharmacocinétiques | |
| Demi-vie d' élimination | 42 secondes |
| Identifiants | |
| |
| Numero CAS | |
| CID PubChem | |
| IUPHAR/BPS | |
| Banque de médicaments | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Tableau de bord CompTox ( EPA ) | |
| Données chimiques et physiques | |
| Formule | C 20 H 32 O 5 |
| Masse molaire | 352,471 g·mol -1 |
| Modèle 3D ( JSmol ) | |
| |
| |
|
| |
La prostacycline (également appelée prostaglandine I2 ou PGI 2 ) est une prostaglandine membre de la famille des eicosanoïdes des molécules lipidiques . Il inhibe l'activation plaquettaire et est également un vasodilatateur efficace.
Lorsqu'il est utilisé comme médicament, il est également connu sous le nom d' époprosténol . Les termes sont parfois utilisés de manière interchangeable.
Fonction
La prostacycline (PGI 2 ) empêche principalement la formation du bouchon plaquettaire impliqué dans l' hémostase primaire (une partie de la formation de caillots sanguins ). Il le fait en inhibant l'activation plaquettaire. C'est aussi un vasodilatateur efficace . Les interactions de la prostacycline contrastent avec celles du thromboxane (TXA 2 ), un autre eicosanoïde. Ceux-ci suggèrent fortement un mécanisme d' homéostasie cardiovasculaire entre ces deux hormones en relation avec les dommages vasculaires .
Utilisations médicales
Il est utilisé pour traiter l'hypertension artérielle pulmonaire .
Dégradation
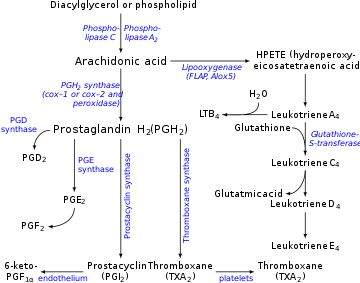
La prostacycline, qui a une demi-vie de 42 secondes, est décomposée en 6-céto-PGF 1 , qui est un vasodilatateur beaucoup plus faible.
Mécanisme
Effet prostacycline Mécanisme Réponse cellulaire
Fonctions classiquesTon du navire AMPc, ET-1
Ca 2+ , K +↓Prolifération des SMC
↑VasodilatationAntiprolifératif AMPc
↑PPARgammaCroissance des fibroblastes
↑ApoptoseAntithrombotique ↓Thromboxane-A2
↓PDGFAgrégation plaquettaire
↓Adhérence plaquettaire à la paroi vasculaire
Fonctions inéditesAnti-inflammatoire IL-1, IL-6
IL-10↓Cytokines pro-inflammatoires
↑Cytokines anti-inflammatoiresAntimitogène VEGF
↓TGF-β↓Angiogenèse
↑ Remodelage de la MEC
Comme mentionné ci-dessus, la prostacycline (PGI 2 ) est libérée par les cellules endothéliales saines et remplit sa fonction via une cascade de signalisation paracrine qui implique des récepteurs couplés à la protéine G sur les plaquettes et les cellules endothéliales avoisinantes. Le récepteur couplé à la protéine Gs des plaquettes ( récepteur de la prostacycline ) est activé lorsqu'il se lie à la PGI 2 . Cette activation, à son tour, signale à l'adénylyl cyclase de produire de l' AMPc . AMPc continue à inhiber toute activation excessive des plaquettes (afin de favoriser la circulation) et contrecarre aussi toute augmentation des niveaux de calcium cytosoliques qui résulterait de la thromboxane A2 (TXA 2 ) la liaison (conduisant à l' activation plaquettaire et après coagulation ). La PGI 2 se lie également aux récepteurs endothéliaux de la prostacycline et, de la même manière, augmente les taux d'AMPc dans le cytosol. Cet AMPc va ensuite activer la protéine kinase A (PKA). La PKA poursuit alors la cascade en favorisant la phosphorylation de la chaîne légère de la myosine kinase , ce qui l'inhibe et entraîne une relaxation et une vasodilatation des muscles lisses . On peut noter que PGI 2 et TXA 2 agissent comme des antagonistes physiologiques.
Membres
| PROSTACYCLINES | |||
|---|---|---|---|
| Flolan (époprosténol sodique) pour injection |
Infusé en continu | 2 ng/kg/min pour commencer, augmenté de 2 ng/kg/min toutes les 15 minutes ou plus jusqu'à ce que l'équilibre efficacité/tolérabilité soit atteint | Classe III Classe IV |
|
Veletri (époprosténol) pour injection |
Infusé en continu | 2 ng/kg/min pour commencer, augmenté de 2 ng/kg/min toutes les 15 minutes ou plus jusqu'à ce que l'équilibre efficacité/tolérabilité soit atteint | Classe III Classe IV |
| Remodulin SC§ ( tréprostinil sodique) Injection |
Infusé en continu | 1,25 ng/kg/min au début, augmenté jusqu'à 1,25 ng/kg/min par semaine pendant 4 semaines, puis jusqu'à 2,5 ng/kg/min par semaine jusqu'à
un bon équilibre efficacité/tolérance est atteint |
Classe II Classe III Classe IV |
|
Solution pour inhalation
Ventavis ( iloprost ) |
Inhalé 6 à 9 fois par jour | 2,5 g 6 à 9 fois par jour pour commencer, augmenté à 5,0 g 6 à 9 fois par jour si bien toléré | Classe III Classe IV |
Pharmacologie
Les analogues synthétiques des prostacyclines ( iloprost , cisaprost ) sont utilisés par voie intraveineuse, sous-cutanée ou par inhalation :
- comme vasodilatateur dans le phénomène de Raynaud sévère ou l' ischémie d'un membre ;
- dans l'hypertension pulmonaire .
- dans l'hypertension pulmonaire primitive (HPP)
La production de prostacycline est inhibée par l'action des AINS sur les enzymes cyclooxygénases COX1 et COX2. Ceux-ci convertissent l'acide arachidonique en prostaglandine H2 (PGH 2 ), le précurseur immédiat de la prostacycline. Le thromboxane (un eicosanoïde stimulateur de l'agrégation plaquettaire) étant également en aval des enzymes COX, on pourrait penser que l'effet des AINS agirait pour équilibrer. Cependant, les concentrations de prostacycline se rétablissent beaucoup plus rapidement que les niveaux de thromboxane, de sorte que l'administration d'aspirine a initialement peu ou pas d'effet mais empêche finalement l'agrégation plaquettaire (l'effet des prostaglandines prédomine lorsqu'elles sont régénérées). Ceci s'explique par la compréhension des cellules qui produisent chaque molécule, TXA 2 et PGI 2 . Puisque la PGI 2 est principalement produite dans une cellule endothéliale nucléée, l'inhibition de la COX par les AINS peut être surmontée avec le temps par une activation accrue du gène COX et la production subséquente de plus d'enzymes COX pour catalyser la formation de PGI 2 . En revanche, le TXA 2 est libéré principalement par les plaquettes anucléées, qui sont incapables de répondre à l'inhibition de la COX par les AINS avec une transcription supplémentaire du gène COX car elles manquent du matériel d' ADN nécessaire pour effectuer une telle tâche. Cela permet aux AINS d'entraîner une dominance de PGI 2 qui favorise la circulation et retarde la thrombose .
Chez les patients souffrant d' hypertension pulmonaire , l'époprosténol inhalé réduit la pression pulmonaire et améliore le volume systolique ventriculaire droit chez les patients subissant une chirurgie cardiaque. Une dose de 60 g est sans danger sur le plan hémodynamique et son effet est complètement inversé après 25 minutes. Aucun signe de dysfonctionnement plaquettaire ou d'augmentation des saignements chirurgicaux après l'administration d'époprosténol inhalé n'a été trouvé. Le médicament est connu pour provoquer des bouffées vasomotrices, des maux de tête et une hypotension.
Synthèse
Biosynthèse
La prostacycline est produite dans les cellules endothéliales , qui tapissent les parois des artères et des veines, à partir de la prostaglandine H 2 (PGH 2 ) par l'action de l' enzyme prostacycline synthase . Bien que la prostacycline soit considérée comme un médiateur indépendant, elle est appelée PGI 2 (prostaglandine I 2 ) dans la nomenclature des eicosanoïdes et fait partie des prostanoïdes (avec les prostaglandines et le thromboxane ). La PGI2, dérivée principalement de la COX-2 chez l'homme, est le principal métabolite de l'arachidonate libéré par l'endothélium vasculaire. C'est un point controversé, certains attribuent la COX 1 comme la principale cyclooxygénase productrice de prostacycline dans les cellules endothéliales des vaisseaux sanguins.
La prostaglandine PGH 3 de la série 3 suit également la voie de la prostacycline synthase, produisant une autre prostacycline, la PGI 3 . Le terme non qualifié « prostacycline » fait généralement référence à la PGI 2 . La PGI 2 est dérivée de l'acide -6 arachidonique . L'IGP 3 est dérivée du -3 EPA .
Synthèse artificielle
La prostacycline peut être synthétisée à partir de l' ester méthylique de la prostaglandine F 2α . Après sa synthèse, le médicament est reconstitué dans une solution saline et de la glycérine.
Histoire
Au cours des années 1960, une équipe de recherche britannique, dirigée par le professeur John Vane , a commencé à explorer le rôle des prostaglandines dans l'anaphylaxie et les maladies respiratoires. En travaillant avec une équipe du Royal College of Surgeons , Vane a découvert que l'aspirine et d'autres médicaments anti-inflammatoires oraux agissent en inhibant la synthèse des prostaglandines. Cette découverte critique a ouvert la porte à une compréhension plus large du rôle des prostaglandines dans le corps.
Une équipe de la Wellcome Foundation dirigée par Salvador Moncada avait identifié un médiateur lipidique appelé « PG-X », qui inhibe l'agrégation plaquettaire. Le PG-X, plus tard connu sous le nom de prostacycline, est 30 fois plus puissant que tout autre agent anti-agrégant connu à l'époque.
En 1976, Vane et ses collègues chercheurs Salvador Moncada , Ryszard Gryglewski et Stuart Bunting ont publié le premier article sur la prostacycline dans Nature . La collaboration a produit une molécule synthétisée, appelée époprosténol. Mais, comme avec la prostacycline native, la molécule d'époprosténol est instable en solution et sujette à une dégradation rapide. Cela a présenté un défi à la fois pour les expériences in vitro et les applications cliniques.
Pour surmonter ce défi, l'équipe de recherche qui a découvert la prostacycline a poursuivi ses recherches. L'équipe de recherche a synthétisé près de 1 000 analogues.
Voir également
Les références
Liens externes
- "Epoprostenol" . Portail d'information sur les médicaments . Bibliothèque nationale de médecine des États-Unis.
- "Époprosténol sodique" . Portail d'information sur les médicaments . Bibliothèque nationale de médecine des États-Unis.