Protamine - Protamine
| Protamine 1 | |||||||
|---|---|---|---|---|---|---|---|
| Identifiants | |||||||
| symbole | PMR1 | ||||||
| gène NCBI | 5619 | ||||||
| HGNC | 9447 | ||||||
| OMIM | 182880 | ||||||
| RéfSeq | NM_002761 | ||||||
| UniProt | P04553 | ||||||
| Autre informations | |||||||
| Lieu | Chr. 16 p13.13 | ||||||
| |||||||
| Protamine 2 | |||||||
|---|---|---|---|---|---|---|---|
| Identifiants | |||||||
| symbole | PMR2 | ||||||
| gène NCBI | 5620 | ||||||
| HGNC | 9448 | ||||||
| OMIM | 182890 | ||||||
| RéfSeq | NM_002762 | ||||||
| UniProt | P04554 | ||||||
| Autre informations | |||||||
| Lieu | Chr. 16 p13.13 | ||||||
| |||||||
Les protamines sont de petites protéines nucléaires riches en arginine qui remplacent les histones à la fin de la phase haploïde de la spermatogenèse et sont considérées comme essentielles à la condensation de la tête des spermatozoïdes et à la stabilisation de l' ADN . Ils peuvent permettre un conditionnement plus dense de l'ADN dans le spermatozoïde que les histones, mais ils doivent être décompressés avant que les données génétiques puissent être utilisées pour la synthèse des protéines. Cependant, chez l'homme et peut-être d'autres primates, 10 à 15 % du génome du sperme est emballé par des histones censées lier des gènes essentiels au développement embryonnaire précoce.
Les protéines de protamine et de type protamine (PL) sont collectivement connues sous le nom de protéines de base nucléaires spécifiques au sperme (SNBP). Les protéines PL ont une structure intermédiaire entre la protamine et l' Histone H1 . Le domaine C-terminal de la PL pourrait être le précurseur de la protamine des vertébrés.
Spermatogenèse
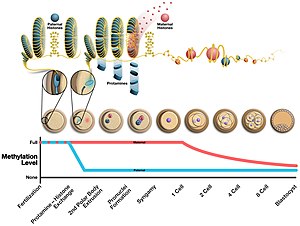
Au cours de la formation du sperme, la protamine se lie au squelette phosphate de l'ADN en utilisant le domaine riche en arginine comme ancre. L'ADN est ensuite replié en un tore , une structure en forme de O, bien que le mécanisme ne soit pas connu. Un spermatozoïde peut contenir jusqu'à 50 000 structures en forme de tore dans son noyau, chaque tore contenant environ 50 kilobases. Avant la formation du tore, les histones sont éliminées de l'ADN par des protéines nucléaires de transition , de sorte que la protamine puisse le condenser. Les effets de ce changement sont 1) une augmentation de l'hydrodynamique des spermatozoïdes pour un meilleur écoulement dans les liquides en réduisant la taille de la tête 2) une diminution de l'apparition de dommages à l'ADN 3) l'élimination des marqueurs épigénétiques qui se produisent avec les modifications des histones.
La structure de la tête des spermatozoïdes est également liée aux niveaux de protamine. Il a été découvert que le rapport de la protamine 2 à la protamine 1 et aux protéines nucléaires de transition modifie la forme de la tête des spermatozoïdes chez diverses espèces de souris, en modifiant l'expression de la protamine 2 via des mutations dans sa région promotrice. Une diminution du rapport s'est avérée augmenter la capacité compétitive des spermatozoïdes chez les espèces Mus . Cependant, des tests supplémentaires sont nécessaires pour déterminer comment ce rapport influence la forme de la tête et si la monogamie influence cette sélection. Chez l'homme, des études montrent que les hommes qui ont Prm1/Prm2 déséquilibré sont hypofertiles ou infertiles. La protamine 2 est codée comme une protéine plus longue qui a besoin de son N-terminal clivé avant de devenir fonctionnelle. La protamine humaine et chimpanzé a connu une évolution rapide.
Utilisations médicales
Lorsqu'elles sont mélangées à de l' insuline , les protamines ralentissent l'apparition et augmentent la durée d'action de l'insuline (voir insuline NPH ).
La protamine est utilisée en chirurgie cardiaque, en chirurgie vasculaire et en radiologie interventionnelle pour neutraliser les effets anticoagulants de l' héparine . Les effets indésirables comprennent une augmentation de la pression artérielle pulmonaire et une diminution de la pression artérielle périphérique, de la consommation d'oxygène du myocarde, du débit cardiaque et de la fréquence cardiaque.
Le sulfate de protamine est un antidote au surdosage d' héparine , mais une allergie grave peut survenir. Une version à chaîne raccourcie de la protamine agit également comme un puissant antagoniste de l'héparine, mais avec une antigénicité nettement réduite . Il a été initialement produit sous la forme d'un mélange obtenu par digestion à la thermolysine de la protamine, mais la portion peptidique réellement efficace VSRRRRRRGGRRRRa depuis été isolée. Un analogue de ce peptide a également été produit.
En thérapie génique, la capacité du sulfate de protamine à condenser l'ADN plasmidique ainsi que son approbation par la Food and Drug Administration (FDA) des États-Unis en ont fait un candidat attrayant pour augmenter les taux de transduction à la fois par voie virale et non virale (par exemple en utilisant des liposomes cationiques). mécanismes.
La protamine peut être utilisée comme médicament pour prévenir l'obésité. Il a été démontré que la protamine dissuade les augmentations de poids corporel et de lipoprotéines de basse densité chez les rats à régime riche en graisses. Cet effet se produit par l'inhibition de l' activité de la lipase , une enzyme responsable de la digestion et de l'absorption des triacylglycérols , entraînant une diminution de l'absorption des graisses alimentaires. Aucun dommage au foie n'a été trouvé lorsque les rats ont été traités avec de la protamine. Cependant, l'émulsification des acides gras à longue chaîne pour la digestion et l'absorption dans l'intestin grêle est moins constante chez l'homme que chez le rat, ce qui variera l'efficacité de la protamine en tant que médicament. De plus, les peptidases humaines peuvent dégrader la protamine à des vitesses différentes, des tests supplémentaires sont donc nécessaires pour déterminer la capacité de la protamine à prévenir l'obésité chez les humains.
Distribution des espèces et isoformes
Les souris, les humains et certains poissons possèdent deux ou plusieurs protamines différentes, tandis que le sperme de taureau et de sanglier possède une forme de protamine due à une mutation du gène PRM2. Chez le rat, bien que le gène de PRM2 soit présent, l'expression de cette protéine est extrêmement faible en raison de la transcription limitée due à un promoteur inefficace en plus du traitement altéré du transcrit de l'ARNm.
Mammifères
Les 2 protamines humaines sont notées PRM1 et PRM2 . Chez la souris et l'homme, PRM1, PRM2 et TRN2 se trouvent dans le même groupe de gènes .
Les mammifères eutheriens ont généralement à la fois PRM1 et PRM2. Les métathériens, en revanche, n'ont qu'un homologue à P1.
Poisson
Des exemples de protamines de poisson sont :
- sulfate de salmine et de protamine de saumon
- clupéine de sperme de hareng ( Clupea )
- iridine de truite arc-en-ciel
- thinnine de thon ( Thunnus )
- stelline d'esturgeon étoilé ( Acipenser stellatus )
- scylliorhinine de l' aiguillat commun ( Scylliorhinus )
La protamine des poissons est généralement plus courte que celle des mammifères, avec une plus grande quantité d'arginine.
Séquence
| Protamine P1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifiants | |||||||||
| symbole | Protamine_P1 | ||||||||
| Pfam | PF00260 | ||||||||
| InterPro | IPR000221 | ||||||||
| PROSITE | PDOC00047 | ||||||||
| |||||||||
| Protamine P2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifiants | |||||||||
| symbole | Protamine_P2 | ||||||||
| Pfam | PF00841 | ||||||||
| InterPro | IPR000492 | ||||||||
| |||||||||
La structure primaire de la protamine P1, la protamine utilisée pour l'emballage de l'ADN dans les spermatozoïdes, chez les mammifères placentaires est généralement longue de 49 ou 50 acides aminés. Cette séquence est divisée en trois domaines distincts : un domaine riche en arginine pour la liaison à l'ADN flanqué de séquences peptidiques plus courtes contenant principalement des résidus de cystéine. Le domaine riche en arginine se compose de 3 à 11 résidus d'arginine et est conservé entre les séquences de protamine de poisson et de protamine 1 de mammifère à environ 60 à 80 % d'identité de séquence.
Structure
Après traduction, la structure de la protamine P1 est immédiatement phosphorylée au niveau des trois domaines mentionnés ci-dessus. Un autre cycle de phosphorylation se produit lorsque le spermatozoïde pénètre dans l'ovule, mais la fonction de ces phosphorylations est incertaine.
La structure secondaire et tertiaire exacte de la protamine n'est pas connue avec certitude, mais plusieurs propositions ont été publiées depuis les années 1970. Le large consensus est que la protamine forme des structures à brin bêta qui se réticulent ensuite par des liaisons disulfure (et potentiellement des liaisons dityrosine et cystéine-tyrosine). Lorsque la protamine P1 se lie à l'ADN, la cystéine de l'extrémité amino d'une protamine P1 forme des liaisons disulfure avec la cystéine de l'extrémité carboxy d'une autre protamine P1. En neutralisant la charge du squelette, la protamine permet à l'ADN de s'enrouler plus étroitement. Les liaisons disulfure ont pour fonction d'empêcher la dissociation de la protamine P1 de l'ADN jusqu'à ce que les liaisons soient réduites lorsque le spermatozoïde pénètre dans l'ovule. Ces longs polymères de protamine peuvent ensuite s'enrouler autour de l'ADN dans le sillon principal.
Voir également
Les références
Liens externes
- Protamines à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis
- V03AB14 ( OMS )

