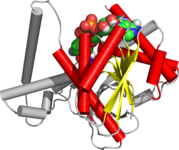
Pli Rossmann - Rossmann fold
| Pli sandwich alpha/bêta/alpha de type Rossmann | |
|---|---|
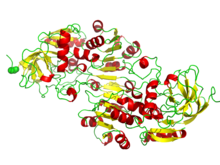 Domaines de pli Rossmann de liaison NAD/NADP. L'image représente le repliement bêta-alpha dans l'alcool déshydrogénase.
| |
| Identifiants | |
| symbole | Rossmann-like_a/b/a_fold |
| Clan Pfam | CL0039 |
| InterPro | IPR014729 |
Le pli Rossmann est un pli tertiaire présent dans les protéines qui se lient aux nucléotides , comme les cofacteurs enzymatiques FAD , NAD + et NADP + . Ce pli est composé de brins bêta et de segments hélicoïdaux alpha alternés où les brins bêta sont liés par des liaisons hydrogène les uns aux autres formant une feuille bêta étendue et les hélices alpha entourent les deux faces de la feuille pour produire un sandwich à trois couches. Le pli de Rossmann classique contient six brins bêta tandis que les plis de type Rossmann, parfois appelés plis de Rossmannoïde, ne contiennent que cinq brins. Le pli initial bêta-alpha-bêta (bab) est le segment le plus conservé du pli Rossmann. Le motif porte le nom de Michael Rossmann qui a remarqué pour la première fois ce motif structurel dans l'enzyme lactate déshydrogénase en 1970 et qui a ensuite observé qu'il s'agissait d'un motif fréquent dans les protéines de liaison aux nucléotides.
Les protéines du pli Rossmann et Rossmannoïde sont extrêmement courantes. Ils représentent 20 % des protéines dont la structure est connue dans la Protein Data Bank et sont présents dans plus de 38 % des voies métaboliques de KEGG . Le pli est extrêmement polyvalent dans la mesure où il peut s'adapter à une large gamme de ligands. Ils peuvent fonctionner comme des enzymes métaboliques, des liaisons ADN/ARN et des protéines régulatrices en plus du rôle traditionnel.
Histoire
Le pli Rossmann a été décrit pour la première fois par le Dr Michael Rossmann et ses collègues en 1974. Il a été le premier à déduire la structure de la lactate déshydrogénase et à caractériser le motif structurel au sein de cette enzyme qui sera plus tard appelé le pli Rossmann. Il a par la suite été découvert que la plupart des déshydrogénases qui utilisent le NAD ou le NADP contiennent ce même motif de pli de Rossmann structurellement conservé.
En 1989, Israel Hanukoglu du Weizmann Institute of Science a découvert que la séquence consensus pour le site de liaison NADP + dans certaines enzymes qui utilisent NADP + diffère du motif de liaison NAD + . Cette découverte a été utilisée pour redéfinir les spécificités des coenzymes des enzymes.
Structure
Le pli Rossmann est composé de six brins bêta parallèles qui forment une feuille bêta étendue . Les trois premiers brins sont reliés par des hélices , ce qui donne une structure bêta-alpha-bêta-alpha-bêta. Ce motif est dupliqué une fois pour produire une répétition en tandem inversée contenant six brins. Globalement, les brins sont disposés dans l'ordre de 321456 (1 = N-terminal, 6 = C-terminal). Cinq plis de type Rossmann sont disposés dans l'ordre 32145. La structure tertiaire globale du pli ressemble à un sandwich à trois couches dans lequel la garniture est composée d'une feuille bêta étendue et les deux tranches de pain sont formées par la connexion parallèle alpha- hélices.
L'une des caractéristiques du pli Rossmann est sa spécificité de liaison au cofacteur . Grâce à l'analyse de quatre enzymes de liaison au NADH, il a été découvert que dans les quatre enzymes, le cofacteur nucléotidique impliquait la même conformation et la même orientation par rapport à la chaîne polypeptidique.
Le pli peut contenir des brins supplémentaires reliés par de courtes hélices ou bobines. Le segment le plus conservé des plis de Rossmann est le premier segment bêta-alpha-bêta. Étant donné que ce segment est en contact avec la partie ADP des dinucléotides tels que FAD , NAD et NADP, il est également appelé « pli bêta-bêta de liaison à l'ADP.
Fonction
La fonction du pli Rossmann dans les enzymes est de lier les cofacteurs nucléotidiques. Il contribue aussi souvent à la liaison au substrat.
Les enzymes métaboliques ont normalement une fonction spécifique, et dans le cas de l' UDP-glucose 6-déshydrogénase , la fonction principale est de catalyser l'oxydation en deux étapes NAD(+)-dépendante de l' UDP-glucose en acide UDP-glucuronique . Les domaines N- et C-terminaux d'UgdG partagent des caractéristiques structurelles avec d'anciennes ribonucléases mitochondriales nommées MAR. Les MAR sont présents dans les micro-organismes eucaryotes inférieurs, ont un pli Rossmannoïde et appartiennent à la superfamille des isochorismatases. Cette observation renforce le fait que les motifs structurels de Rossmann trouvés dans les déshydrogénases NAD(+)-dépendantes peuvent avoir une double fonction fonctionnant comme domaine de liaison de cofacteur nucléotidique et comme ribonucléase.
Évolution
Rossman et Rossmannoïdes
La relation évolutive entre le pli de Rossmann et les plis de type Rossmann n'est pas claire. Ces plis sont appelés Rossmannoïdes. Il a été émis l'hypothèse que tous ces plis, y compris un pli Rossmann, provenaient d'un seul pli ancestral commun, qui avait des capacités de liaison aux nucléotides, en plus d'une activité catalytique non spécifique.
Cependant, une analyse de l'APB trouve des preuves d' une évolution convergente avec 156 groupes H séparés d'homologie démontrable, à partir desquels 123 groupes X d'homologie probable peuvent être trouvés. Les groupes ont été intégrés à ECOD .
Groupe Rossman conventionnel
L'analyse phylogénétique de l' adrénodoxine réductase, une enzyme de liaison au NADP, a révélé que des procaryotes, en passant par les métazoaires et jusqu'aux primates, la différence de motif de séquence par rapport à la plupart des sites de liaison FAD et NAD est strictement conservée.
Dans de nombreux articles et manuels, un pli Rossmann est défini comme une série répétée stricte de structure . Pourtant, un examen complet des plis de Rossmann dans de nombreux sites de liaison NAD(P) et FAD a révélé que seule la première structure est strictement conservée. Dans certaines enzymes, il peut y avoir de nombreuses boucles et plusieurs hélices (c'est-à-dire pas une seule hélice) entre les brins bêta qui forment le feuillet bêta. Ces enzymes ont une origine commune indiquée par une séquence conservée et des caractéristiques structurelles, selon Hanukoglu.
Le résultat de Hanukoglu (2017) est corroboré par Medvedev et al. (2020), sous la forme d'un ECOD « groupe H » appelé « lié à Rossmann ». Même au sein de ce groupe, ECOD décrit un large éventail d'activités non nucléotidiques.