Zone d'activité polarisante - Zone of polarizing activity
| Zone d'activité polarisante | |
|---|---|
 La crête ectodermique apicale est un épithélium épaissi à l'extrémité la plus distale du bourgeon de membre. La zone d'activité polarisante se situe à la partie postérieure du bourgeon de membre.
| |
| Des détails | |
| Identifiants | |
| Latin | zona activitatis polarisantis |
| Acronyme(s) | ZPA |
| TE | de polarisation activité_by_E5.0.3.0.0.1.5 E5.0.3.0.0.1.5 |
| Terminologie anatomique | |
La zone d'activité polarisante (ZPA) est une zone de mésenchyme qui contient des signaux qui ordonnent au bourgeon de membre en développement de se former le long de l'axe antérieur/postérieur. Le bourgeon de membre est un mésenchyme indifférencié entouré d'un revêtement d' ectoderme . Finalement, le bourgeon de membre se développe en os, tendons, muscles et articulations. Le développement des bourgeons des membres repose non seulement sur la ZPA, mais également sur de nombreux gènes, signaux et une région unique de l'ectoderme appelée crête ectodermique apicale (AER). Des recherches menées par Saunders et Gasseling en 1948 ont identifié l'AER et son implication ultérieure dans l'excroissance distale proximale. Vingt ans plus tard, le même groupe a réalisé des études de transplantation dans le bourgeon de membre de poulet et a identifié le ZPA. Ce n'est qu'en 1993 que Todt et Fallon ont montré que l'AER et la ZPA sont dépendantes l'une de l'autre.
Motifs
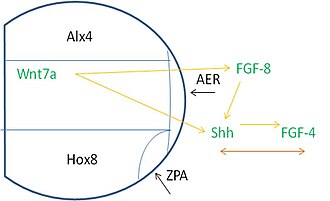
La formation de motifs le long du bourgeon de membre nécessite des signaux provenant de nombreuses sources. Plus précisément, des protéines appelées facteurs de transcription (TF) aident à contrôler la vitesse à laquelle un gène est transcrit. Le bourgeon de membre exprime un TF appelé ALX4 à la partie antérieure du mésoderme , le TF HOXB8 étant exprimé à la partie postérieure. La région Alx4, la région médiale et la zone d'expression Hox8 se rencontrent dans une zone proximale où l'AER se développe. La ZPA se forme là où la région Hox8 rejoint l'ARE.
Ces régions dépendent de la signalisation pour que les événements d'induction appropriés se produisent. L'AER exprime le FGF8 qui induit l' expression de Shh dans le mésoderme postérieur. Shh stimule alors l' expression du FGF4 dans la partie postérieure de l'ARE. Après ces événements, il existe une co-dépendance entre FGF-4 et Shh pour leur expression et leur maintien ultérieurs. De plus, Wnt7a est exprimé dans l'ectoderme dorsal, est nécessaire pour maintenir la signalisation FGF et Shh.
Crête ectodermique apicale
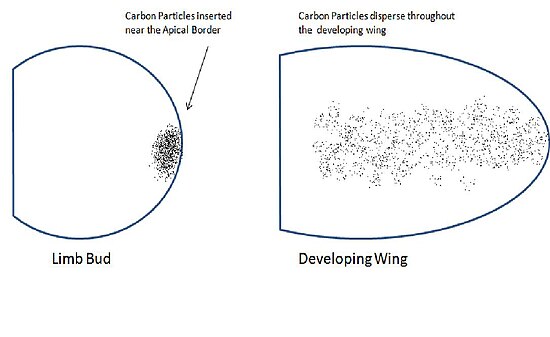
Saunders et Gasseling ont publié des données dans le Journal of Experimental Biology en 1948, montrant que les marques de référence insérées près du bord du bord apical du bourgeon de l'aile sont dispersées dans tout l'avant-bras de l'aile. Cela les a amenés à croire que l'ectoderme apical peut jouer un rôle dans la formation de parties de l'aile. Pour tester cela, ils ont retiré l'ectoderme apical des bourgeons alaires qui ont donné des ailes déformées. Lorsqu'ils ont retiré l'ectoderme dorsal, des ailes normales se sont formées. Ces résultats ont montré que les cellules de l'ectoderme apical ont un destin précis pour former des régions spécifiques de l'aile.
Hérisson sonique
En 1968, Saunders et Gasseling ont réalisé des études de transplantation en utilisant du tissu de bourgeon de membre de poulet. En retirant des cellules de la région postérieure du membre, ils les ont transplantées dans la région antérieure et ont remarqué que des chiffres supplémentaires se formaient dans la région antérieure et que ces chiffres étaient des images miroir des normales. Ce mésenchyme postérieur était le ZPA, qui est maintenant connu pour exprimer la protéine sonic hedgehog (Shh). Une hypothèse est qu'à des concentrations élevées, ce morphogène inconnu provoque la formation de mésenchyme sur la face postérieure, tandis que de faibles concentrations induit la formation de mésenchyme sur l'extrémité antérieure. L'identification de ce morphogène était la prochaine étape cruciale. La première hypothèse est venue de Tickle et al. qui a montré que lorsque l'acide rétinoïque est placé dans la marge antérieure du bourgeon de membre, des duplications d'image miroir en résultent. Cependant, les concentrations d'acide rétinoïque qui provoquent des duplications d'images miroir induisent des niveaux élevés d'un gène en aval, le récepteur bêta de l'acide rétinoïque, qui n'est pas observé dans la région postérieure. Il est maintenant connu que l'acide rétinoïque endogène agit de manière permissive avant l'initiation du bourgeon de membre pour permettre le début du processus de bourgeonnement, et que le morphogène spécifique, supposé être Shh, est normalement exprimé indépendamment de l'acide rétinoïque dans la région postérieure du bourgeon de membre. En examinant les homologues de signalisation d'autres organismes, le gène de segmentation de Drosophila , hedgehog, a servi de candidat viable.
L'idée que Shh est nécessaire pour une signalisation ZPA appropriée et la formation des membres antérieurs/postérieurs devait être testée. Jedusor et al. a fait passer les découvertes de Saunders et Gasselings à l'étape suivante et a prouvé que Shh est le morphogène au sein de la ZPA qui est requis pour la structuration antéro-postérieure. En isolant le gène Shh et en l'implantant dans le bourgeon de membre antérieur, des duplications de chiffres d'image miroir se sont formées.
L'isolement a été réalisé en concevant des amorces PCR qui correspondent aux séquences de Shh qui sont conservées chez la drosophile et la souris et impliquées dans la formation des bourgeons des membres. Le clone a ensuite été utilisé comme matrice pour cribler une banque d'ADNc à partir d'ARN de bourgeon de membre au stade 22. Le groupe a exprimé le gène de manière ectopique en profitant d'un vecteur rétroviral pour insérer l'ADNc dans des cellules de poulet. Il existe des types uniques de ce vecteur rétroviral qui n'infectent que des souches spécifiques d'espèces aviaires. Par conséquent, ce groupe a utilisé un vecteur rétroviral appelé RCAS-E, qui manque d'une protéine d'enveloppe de type E et est capable d'infecter certains fibroblastes d'embryons de poulet avec Shh.
Les résultats ont montré des duplications de chiffres, le plus courant étant le 4-3-3-4, le chiffre 2 manquant. Bien qu'il y ait eu de la variabilité, elle était clairement cohérente avec la structuration positionnelle antérieure à postérieure. Les variations étaient dues à la quantité de tissu greffé et à l'emplacement de la greffe. Ces résultats indiquent que Shh pourrait se substituer à la fonction de la ZPA. Ainsi Shh est suffisant pour l'action ZPA.
Médiateurs
Shh peut être un signal critique régulant la fonction ZPA, mais les gènes impliqués dans la signalisation Shh sont sous le contrôle de plusieurs autres facteurs nécessaires au maintien et à la fonction de ZPA, notamment Hand2 et Hoxb-8. L'acide rétinoïque , une molécule de signalisation importante nécessaire tout au long de l'embryogenèse, agit par l'intermédiaire des gènes Hox. Il a été initialement postulé que l'acide rétinoïque agit pour induire le gène Hoxb-8, mais cette hypothèse n'a pas été étayée par des études génétiques sur des embryons de souris dépourvus de synthèse d'acide rétinoïque qui expriment encore Hoxb-8 dans le membre. La signalisation Hoxb-8 est active dans l'embryon précoce, commençant à l'extrémité postérieure du mésoderme de la plaque latérale et s'étendant à la région antérieure. Au fur et à mesure que Hoxb-8 se propage à des régions plus antérieures, Shh est induit dans la zone qui deviendra la ZPA. Shh n'est induit que dans la région antérieure à cause des signaux de l'AER. Les expériences faites par Heikinheimo et al. montrent que lorsque l'AER est retiré, les billes qui expriment le FGF sont suffisantes pour induire la signalisation Shh dans la ZPA. Ainsi, le facteur de signalisation probable de l'AER est le FGF.
De plus, lorsque l'AER est supprimé, Shh n'est plus exprimé et le ZPA ne peut plus être maintenu. Agissant dans un mécanisme de rétroaction positive, le FGF-4 s'exprime à proximité de la ZPA. Le FGF-4 agit pour maintenir l'expression de Shh, tandis que Shh agit pour maintenir l'expression de FGF-4. Dans le même temps, Wnt-7a est exprimé dans l'ectoderme dorsal et fournit une rétroaction positive supplémentaire à FGF-4 et Shh. Sans ce système, les membres et les doigts sont considérablement réduits ou manquants.
Signaux en aval
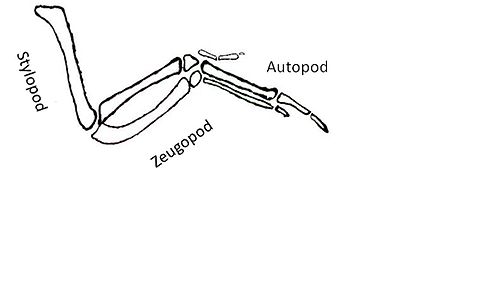
Les cibles en aval qui sont activées en réponse à Shh posent un autre défi. Les gènes cibles de la signalisation Shh codent pour des facteurs qui conduisent à la formation de l' autopode , du stylopode et du zeugopode .
L'activation des facteurs de transcription à doigt de zinc Gli se produit par la voie de signalisation Hedgehog . Il existe trois facteurs Gli essentiels au développement des membres : Gli1 , Gli2 et Gli3 . Sans Shh, Gli2 et Gli3 sont transformés en une forme de répresseur et voyagent jusqu'au noyau pour réprimer la réponse Shh. Mais lorsque Shh est présent, Gli2 et Gli3 non transformés sont capables de passer dans le noyau et de stimuler l'expression des gènes cibles de Shh, y compris Gli1. Des études chez la souris montrent que les knock-out Gli3 ont des doigts de polydactylie . Fondamentalement, Shh agit pour supprimer la répression de Gli3. Lorsque Shh diffuse à partir de la ZPA, il prédomine dans la région postérieure du bourgeon de membre, activant Gli3 dans la région postérieure, tandis que le répresseur est toujours actif dans la région antérieure. Cela conduit à l'activation d'autres gènes tels que les gènes Hox, les gènes FGF et les gènes BMP dans la région postérieure, créant ainsi une structuration des chiffres. La BMP joue un rôle dans la morphologie des membres, en particulier le positionnement des doigts, mais la régulation spécifique de la BMP n'est pas claire.
En particulier, les gènes Hox A et D sont susceptibles d'être contrôlés par Shh au sein de la ZPA. Trois phases d'activation des gènes Hox entraînent une structuration du membre parallèle à l'expression des gènes Hox dans un motif emboîté. L'activation de ces gènes se traduit par un nouvel axe des membres qui aboutit finalement au développement des chiffres, interprétant éventuellement l'expression des gènes pour attribuer une identité aux chiffres. Dans l'ensemble, le ZPA moléculaire nécessite une entrée pour plusieurs centres de signalisation, mais agit comme un organisateur lui-même, induisant un motif antéro-postérieur du bourgeon de membre du poussin.