Asparagine peptide lyase - Asparagine peptide lyase
L'asparagine peptide lyase est l'un des sept groupes dans lesquels les protéases , également appelées enzymes protéolytiques, peptidases ou protéinases, sont classées en fonction de leur résidu catalytique. Le mécanisme catalytique des peptides lyases d' asparagine implique un résidu d' asparagine agissant comme nucléophile pour effectuer une réaction d' élimination nucléophile , plutôt qu'une hydrolyse , pour catalyser la rupture d' une liaison peptidique .
L'existence de ce septième type catalytique de protéases, dans lequel le clivage de la liaison peptidique se produit par auto-traitement au lieu d'hydrolyse, a été démontrée avec la découverte de la structure cristalline du précurseur auto-clivant de l'autotransporteur Tsh d' E . coli .
Synthèse
Ces enzymes sont synthétisées sous forme de précurseurs ou de propeptides, qui se clivent par une réaction autoprotéolytique.
La nature auto-clivante des asparagine peptide lyase contredit la définition générale d'une enzyme étant donné que l'activité enzymatique détruit l'enzyme. Cependant, l'auto-traitement est l'action d'une enzyme protéolytique, bien que l'enzyme ne soit pas récupérable de la réaction.
Site actif et mécanisme catalytique
Toute l'activité protéolytique des peptides lyases d'asparagine n'est que des auto-clivages, puis aucune autre activité peptidase ne se produit.
Le principal résidu du site actif est l'asparagine et il existe d'autres résidus impliqués dans le mécanisme catalytique , qui sont différents entre les différentes familles de peptides lyases d'asparagine.
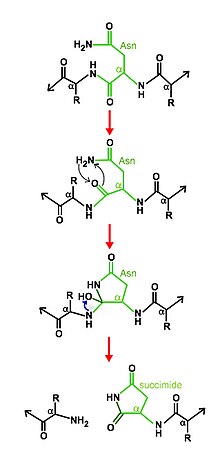
Le mécanisme de clivage consiste en la cyclisation de l'asparagine, assistée par d'autres résidus du site actif. Dans certaines conditions, la structure cyclique de l'asparagine attaque nucléophile sa liaison peptidique C-terminale à la chaîne principale formant une nouvelle liaison pour créer un succinimide stable , se clivant de la chaîne principale et libérant par conséquent les deux moitiés du produit.
Inhibition
Aucun inhibiteur n'est connu.
Classification
La base de données de protéases MEROPS comprend les dix familles suivantes de peptides lyases d'asparagine, qui sont incluses dans 6 clans différents de protéases.
Les enzymes protéolytiques sont classées en familles sur la base de la similarité de séquence. Chaque famille comprend des enzymes protéolytiques avec des séquences homologues et un type catalytique commun. Les clans sont des groupes de familles d'enzymes protéolytiques avec des structures apparentées, où le type catalytique n'est pas conservé.
| Clan | Famille | Identifiant MEROPS | Peptidases et homologues | NC- IUBMB | Identifiant PDB |
| N / A | N1 | N01.001 | protéine d'enveloppe de nodavirus | 3.4.23.44 | 2BBV |
| Non attribué | lyases peptidiques non attribuées de la famille N1 | * | - | ||
| N2 | N02.001 | protéine d'enveloppe du tétravirus | * | 1OHF | |
| homologue non peptidasique | homologues non lyases de la famille N2 | * | - | ||
| Non attribué | peptides lyases non attribués de la famille N2 | * | - | ||
| N8 | N08.001 | protéine auto-clivante de type VP0 de capside de picornavirus | * | 1NCQ | |
| homologue non peptidasique | homologues non lyases de la famille N8 | * | - | ||
| Non attribué | lyases peptidiques non attribuées de la famille N8 | * | - | ||
| NB | N6 | N06.001 | Protéine YscU ( Yersinia pseudotuberculosis ) | * | 2JLJ |
| N06.002 | Protéine SpaS ( Salmonella sp.) | * | 3C01 ; 2VT1 | ||
| N06.003 | Protéine EscU ( Escherichia coli ) | * | 3BZO | ||
| N06.004 | Protéine HrcU ( Xanthomonas sp.) | * | - | ||
| N06.A01 | Protéine FlhB ( Escherichia coli ) | * | - | ||
| homologue non peptidasique | homologues non lyases de la famille N6 | * | - | ||
| Non attribué | lyases peptidiques non attribuées de la famille N6 | * | - | ||
| NC | N7 | N07.001 | protéine d'enveloppe du réovirus de type 1 | * | 1JMU |
| N07.002 | protéine d'enveloppe d'aquaréovirus | * | - | ||
| Non attribué | lyases peptidiques non attribuées de la famille N7 | * | - | ||
| ND | N4 | N04.001 | Domaine d'auto-clivage associé à la Tsh ( Escherichia coli ) et similaire | * | 3AEH |
| N04.002 | Domaine d'autotransporteur de protéine gamma EspP ( type Escherichi ) | * | 2QOM | ||
| homologue non peptidasique | homologues non lyases de la famille N4 | * | - | ||
| Non attribué | lyases peptidiques non attribuées de la famille N4 | * | - | ||
| NE | N5 | N05.001 | protéine d'auto-clivage du picobirnavirus | * | 2VF1 |
| Non attribué | lyases peptidiques non attribuées de la famille N5 | * | - | ||
| PD | N9 | N09.001 | sous-unité catalytique A de l'ATPase du proton de type V contenant une intéine | 3.6.3.14 | 1VDE |
| homologue non peptidasique | homologues non lyases de la famille N9 | * | - | ||
| Non attribué | lyases peptidiques non attribuées de la famille N9 | * | - | ||
| N10 | N10.001 | précurseur de la sous-unité A de l'ADN gyrase contenant de l'intéine | * | - | |
| N10.002 | précurseur d'hélicase d'ADN réplicatif contenant de l'intéine | * | 1MI8 | ||
| N10.003 | précurseur de la sous-unité alpha de l'ADN polymérase III contenant de l'intéine | 2.7.7.7 | 2KEQ | ||
| N10.004 | précurseur du facteur d'initiation de la traduction contenant une intéine IF-2 | - | |||
| N10.005 | ADN polymérase II contenant de l'intéine précurseur de la grande sous-unité DP2 Mername-AA281 | * | - | ||
| N10.006 | ADN polymérase II contenant de l'intéine précurseur de la grande sous-unité DP2 Mername-AA282 | 2.7.7.7 | - | ||
| N10.007 | précurseur d'ADN polymérase ADN-dépendant contenant une intéine | * | 2CW7 ; 2CW8 | ||
| N10.008 | sous-unité A de l'ADN gyrase contenant de l'intéine ( Mycobacterium xenopi ) | * | 1AM2 ; 4OZ6 | ||
| N10.009 | Intéine Mtu recA ( Mycobacterium sp.) | * | 2EN9 | ||
| homologue non peptidasique | homologues non lyases de la famille N10 | * | - | ||
| Non attribué | lyases peptidiques non attribuées de la famille N10 | * | - | ||
| N11 | N11.001 | chloroplaste contenant de l'intéine peptidique lyase dépendante de l'ATP | * | - | |
| homologue non peptidasique | homologues non lyases de la famille N11 | * | - | ||
| Non attribué | lyases peptidiques non attribuées de la famille N11 | * | - |
*Pas encore inclus dans les recommandations de l' IUBMB .
Répartition et types
Les dix familles différentes de peptides lyases d'asparagine se répartissent en trois types différents :
- Protéines de l'enveloppe virale
- Protéines autotransporteuses
- Protéines contenant des intéines
Il existe cinq familles de protéines d'enveloppe virales (N1, N2, N8, N7 et N5), deux familles de protéines autotransporteuses (N6 et N4) et trois familles de protéines contenant des intéines (N9, N10 et N11).
Protéines de l'enveloppe virale
Il existe cinq familles de protéines d'enveloppe virales dans lesquelles la transformation se produit au niveau d'un résidu d'asparagine. Ces cinq familles sont regroupées en trois clans : le clan NA (Familles N1, N2 et N8), le clan NC (Famille N7) et le clan NE (Famille N5).
Famille N1 : Le clivage autolytique connu est médié par l' endopeptidase nodavirus , à partir de l'extrémité C-terminale de la protéine d'enveloppe et ne se produit que dans le virion assemblé .
Famille N2 : Comprend les tétravirus endopeptidases. Le clivage autolytique connu provient de l'extrémité C-terminale de la protéine d'enveloppe. Le clivage se produit pendant les derniers stades de l'assemblage du virion.
Famille N8 : Le clivage autolytique connu se situe dans la protéine de capside virale VP0 du poliovirus en VP2 et Vp4 dans le provirion.
Famille N7 : Le clivage autolytique connu provient de l' extrémité N-terminale de la protéine d'enveloppe.
Famille N5 : Le clivage autolytique connu provient de l' extrémité N-terminale de la protéine d'enveloppe.
Protéines autotransporteuses
Les protéines autotransporteuses sont des protéines de la membrane externe ou des protéines sécrétées présentes dans une grande variété de bactéries Gram-négatives . Ces protéines contiennent trois motifs structurels : une séquence signal, un domaine passager situé à l'extrémité N-terminale et un domaine translocateur ou autotransporteur situé à l'extrémité C-terminale, formant une structure en tonneau bêta . Ces structures favorisent l'autotransport des protéines. Les protéines autotransporteuses sont généralement liées à des fonctions de virulence. Ce fait, leur interaction avec les cellules hôtes et la large occurrence de gènes codant pour les autotransporteurs, ouvrent la possibilité de représenter des cibles thérapeutiques pour la conception de vaccins contre les pathogènes Gram-négatifs.
Deux des familles dans lesquelles la base de données MEROPS classe les asparagine peptide lyase sont des protéines autotransporteuses, les familles N4 et N6.
La famille N4 comprend les facteurs de virulence sécrétés, ou autotransporteurs, des entérobactéries. Leur seule activité protéolytique est de libérer le facteur de virulence du précurseur, ce qui lui permet d'être sécrété. Les résidus du site actif dans les lyases peptidiques de l'asparagine de la famille N4 sont N1100, Y1227, E1249 et R1282.
La famille N6 comprend les endopeptidases d' autotraitement impliquées dans le système de sécrétion des protéines de type III, dans lequel l'autoprotéolyse est essentielle pour la médiation de la sécrétion des protéines. Le système de sécrétion de type III sécrète des protéines directement dans les cellules hôtes par un injectisome, une structure tubulaire creuse qui pénètre dans la cellule hôte. Les protéines sécrétées peuvent passer à travers l' injectisome dans le cytoplasme de la cellule hôte. Le résidu de site actif conservé dans les peptides lyases d'asparagine de la famille N6 est N263.
Protéines contenant des intéines
Une intéine est une protéine contenue dans une autre protéine, l' extéine . L'ADN parasite infecte un gène de l'intéine, qui code pour une endonucléase . L' ADNc résultant (ADN complémentaire) code pour l'extéine avec l'intéine. L'intéine contient un domaine d'auto-clivage, dans lequel l'endonucléase est nichée. Le domaine intéine effectue deux clivages protéolytiques à ses propres extrémités N-terminale et C-terminale et se libère de l'extéine, la séparant en deux fragments. Ces deux fragments sont ensuite épissés ensemble et l'exteine reste sous forme de protéine complètement fonctionnelle.
Le résidu N-terminal du domaine intéine doit être une sérine , une thréonine ou une cystéine , et il attaque sa liaison peptidique précédente pour former un ester ou un thioester. Le premier résidu de la deuxième portion de l'extéine doit être également une sérine, une thréonine ou une cystéine, et ce deuxième nucléophile forme un intermédiaire ramifié. Le résidu C-terminal du domaine intéine est toujours une asparagine, qui cyclise pour former un succinimide, clivant sa propre liaison peptidique et libérant l'intéine de l'extéine. Enfin, dans l'extéine, la liaison ester ou thioester est réarrangée pour former une liaison peptidique normale.
Il existe trois familles connues de protéines contenant des intéines (N9, N10 et N11), toutes incluses dans le clan PD, qui contient des enzymes protéolytiques de différents types catalytiques. La structure tertiaire a été résolue pour la sous-unité catalytique du proton ATPase de type intéine V ( Saccharomyces cerevisiae ), un membre de la famille N9 et pour plusieurs intéines de la famille N10.
Voir également
Les références
Lectures complémentaires
- Rawlings ND, Barrett AJ, Bateman A. Asparagine peptide lyases: un septième type catalytique d'enzymes protéolytiques . 4 novembre 2011; 286(44):38321-8.
- Alan J. Barrett, Neil D. Rawlings, J. Fred (2012). Manuel des enzymes protéolytiques . Troisième édition. ISBN 9780123822208
- Guoyao Wu (2013) Acides aminés : biochimie et nutrition . ISBN 9781439861899
- Klaudia Brix, Walter Stöcker (21 janvier 2014). Protéases : Structure et fonction . ISBN 9783709108857
- Jin Zhang, Sohum Mehta, Carsten Schultz (2016). Sondes optiques en biologie . ISBN 9781466510128
Liens externes
|
Ressources de la bibliothèque sur l' asparagine peptide lyase |
- Société internationale de protéolyse
- Interface graphique des sites de coupure de protéase
- Merops - la base de données des peptidases
- La carte de la protéolyse
- Base de données de protéases TopFIND couvrant les sites coupés, les substrats et les terminaisons protéiques
- Liste des protéases et leurs spécificités (voir aussi [1] )
- Protéases à la National Library of Medicine Medical Subject Headings (MeSH) des États-Unis