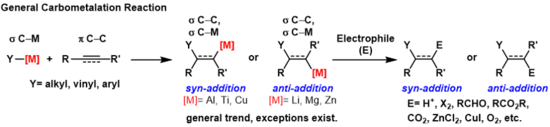
Carbométallation - Carbometalation
Une carbométallation est une réaction dans laquelle une liaison carbone-métal réagit avec une liaison carbone-carbone pour produire une nouvelle liaison carbone-carbone et une liaison carbone-métal. La liaison carbone-métal résultante peut subir d'autres réactions de carbométallisation (oligomérisation ou polymérisation voir polymérisation Ziegler-Natta ) ou elle peut être mise à réagir avec une variété d' électrophiles, y compris des réactifs d'halogénation, des carbonyles , de l'oxygène et des sels inorganiques pour produire différents réactifs organométalliques. Les carbométallations peuvent être effectuées sur des alcynes et des alcènes pour former des produits avec une pureté géométrique élevée ou une énantiosélectivité , respectivement. Certains métaux préfèrent donner l' anti- -Ajout produit avec une sélectivité élevée et certains rendement du syn plus produit. Le résultat des produits syn et anti -addition est déterminé par le mécanisme de la carbométallation.
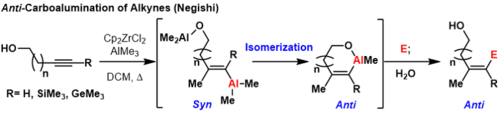
Carboalumination
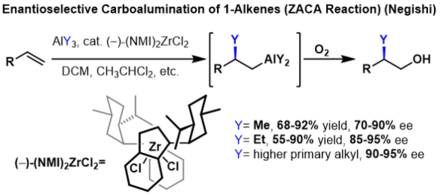
La réaction de carboalumination est le plus souvent catalysée par le dichlorure de zirconocène (ou un catalyseur apparenté). Certaines carboaluminations sont réalisées avec titanocène complexes. Cette réaction est parfois appelée carboalumination asymétrique d'alcènes catalysée par Zr (ZACA) ou méthylalumination d'alcynes catalysée par Zr (ZMA).
Les réactifs trialkylaluminium les plus courants pour cette transformation sont le triméthylaluminium , le triéthylaluminium et parfois le triisobutylaluminium . Lors de l'utilisation de réactifs trialkylaluminium contenant des bêta-hydrures , les éliminations et les réactions d'hydroaluminium deviennent des processus concurrents. Le mécanisme général de la réaction ZMA peut être décrit comme d'abord la formation de l'espèce catalytique active à partir du pré-catalyseur dichlorure de zirconocène par sa réaction avec le triméthylaluminium. La première transmétallation d'un méthyle de l'aluminium au zirconium se produit. Ensuite, l'extraction de chlorure par l'aluminium crée une espèce de zirconium cationique qui est étroitement associée à un complexe d'aluminium anionique. Ce cation zirconium peut coordonner un alcène ou un alcyne où s'effectue alors l' insertion migratoire d'un méthyle. Les espèces de vinyle ou d'alkyl zirconium résultantes peuvent subir une transmétallation réversible mais stéréorétentive avec un organoaluminium pour fournir le produit de carboalumination et la régénération du catalyseur de dichlorure de zirconcène. Ce procédé fournit généralement le produit d'addition syn ; cependant, des conditions existent pour fournir le produit anti-addition par le biais d'un mécanisme modifié.
Triméthyl silyle ( TMS ) des alcynes protégées, triméthyl germanium alcynes, et les alcynes terminaux peuvent produire des produits anti-carboalumination à la température ambiante ou à des températures élevées si un groupe de coordination est à proximité sur le substrat . Dans ces réactions, la première syn-carboalumination a lieu selon le mécanisme décrit précédemment. Ensuite, un autre équivalent de l'aluminium qui est coordonné au groupe directeur peut déplacer le vinyle aluminium, inversant la géométrie au niveau du carbone où le déplacement a lieu.
Cela forme un métallacycle thermodynamiquement favorable pour empêcher les inversions ultérieures. Formellement, ce procédé fournit des produits anti-carboalumination qui peuvent être trempés avec des électrophiles. Une limitation de cette méthodologie est que le groupe directeur doit être suffisamment proche de la liaison carbone-carbone pour former un cycle thermodynamiquement favorable, sinon des mélanges d' isomères géométriques se formeront.
La carboalumination des alcènes pour former des alcanes substitués peut être rendue énantiosélective si des alcènes prochiraux sont utilisés. Dans ces réactions, un catalyseur chiral d' indényl zirconium est utilisé pour induire une énantiosélectivité. Dans ces réactions, des énantiosélectivités élevées ont été obtenues pour plusieurs réactifs trialkylaluminium, cependant, le rendement diminue considérablement avec chaque carbone supplémentaire de la chaîne alkyle sur le réactif trialkylaluminium.
Carbolithiation
La carbolithiation est l'ajout d'un réactif organolithien à travers une liaison pi carbone-carbone. Les réactifs organolithiens utilisés dans cette transformation peuvent être commerciaux (tels que le n-butyllithium ) ou peuvent être générés par déprotonation ou échange lithium-halogène . Des exemples inter- et intramoléculaires de carbolithiation existent et peuvent être utilisés en synthèse pour générer de la complexité. Les organolithiens sont des produits chimiques hautement réactifs et souvent le réactif organolithien résultant généré par la carbolithiation peut continuer à réagir avec les électrophiles ou le matériau de départ restant (entraînant une polymérisation ). Cette réaction a été rendue énantiosélective grâce à l'utilisation de spartéine , qui peut chélater l'ion lithium et induire la chiralité . Aujourd'hui, ce n'est pas une stratégie courante en raison d'une pénurie de spartéine naturelle. Cependant, les progrès récents dans la synthèse de substituts de la spartéine et leur application efficace dans la carbolithiation ont réactivé l'intérêt pour cette stratégie.
Une autre démonstration de ce type de réaction est une voie alternative au tamoxifène à partir du diphénylacétylène et de l' éthyllithium : l'électrophile captant ici est le borate de triisopropyle formant l' acide boronique R–B(OH) 2 . La deuxième étape complétant le tamoxifène est une réaction de Suzuki .
En conséquence de la grande réactivité des organolithiens en tant que bases fortes et nucléophiles forts , la portée du substrat de la carbolithiation est généralement limitée aux produits chimiques qui ne contiennent pas de groupes fonctionnels acides ou électrophiles .
Carbomagnésiation et Carbozincation
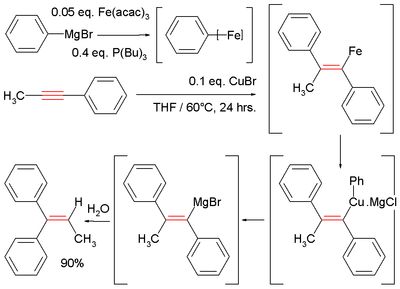
En raison de la diminution de la nucléophilie des réactifs de Grignard ( réactifs organomagnésiens) et des réactifs organozinciques , les réactions de carbomagnésiation et de carbozincation non catalysées ne sont généralement observées que sur des alcènes et des alcynes activés ou tendus . Par exemple, les groupes électroattracteurs comme les esters , les nitriles ou les sulfones doivent être en conjugaison avec le système π carbone-carbone (voir l' addition de Michael ) ou un groupe directeur comme un alcool ou une amine doit être à proximité pour diriger la réaction. Ces réactions peuvent être catalysées par une variété de métaux de transition tels que le fer, le cuivre, le zirconium, le nickel, le cobalt et autres.
Un exemple est la réaction catalysée par Fe du méthylphénylacétylène avec le bromure de phénylmagnésium , qui génère un intermédiaire vinylmagnésien. L'hydrolyse donne le diphénylalcène :
Carbopalladation
Les carbopalladations peuvent être une description de l'étape élémentaire d'une réaction catalysée par un catalyseur au palladium ( réaction de Mizoroki-Heck ) et peuvent également faire référence à une réaction de carbométallation avec un catalyseur au palladium ( difonctionnalisation alcène , hydrofonctionnalisation , ou diable réductrice )