Cinnamaldéhyde - Cinnamaldehyde
|
|
|
|

|
|
| Noms | |
|---|---|
|
Nom IUPAC préféré
(2 E )-3-Phénylprop-2-énal |
|
| Autres noms | |
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| 3DMet | |
| 1071571 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Banque de médicaments | |
| Carte d'information de l'ECHA |
100.111.079 |
| Numéro CE | |
| KEGG | |
|
CID PubChem
|
|
| Numéro RTECS | |
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 9 H 8 O | |
| Masse molaire | 132,16 g/mol |
| Apparence | Huile jaune |
| Odeur | Piquant, semblable à la cannelle |
| Densité | 1,0497 g/ml |
| Point de fusion | −7,5 °C (18,5 °F; 265,6 K) |
| Point d'ébullition | 248 °C (478 °F; 521 K) |
| Légèrement soluble | |
| Solubilité | |
| −7,48 × 10 −5 cm 3 /mol | |
|
Indice de réfraction ( n D )
|
1.6195 |
| Dangers | |
| Pictogrammes SGH |

|
| Mention d'avertissement SGH | Avertissement |
| H315 , H317 , H319 , H335 | |
| P261 , P264 , P271 , P272 , P280 , P302 + 352 , P304 + 340 , P305 + 351 + 338 , P312 , P321 , P332 + 313 , P333 + 313 , P337 + 313 , P362 , P363 , P403 + 233 , P405 , P501 | |
| NFPA 704 (diamant de feu) | |
| point de rupture | 71 °C (160 °F; 344 K) |
| Dose ou concentration létale (LD, LC) : | |
|
DL 50 ( dose médiane )
|
3400 mg/kg (rat, orale) |
| Composés apparentés | |
|
Composés apparentés
|
Acide cinnamique |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
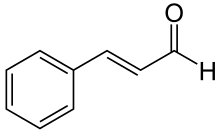
Le cinnamaldéhyde est un composé organique de formule C 6 H 5 CH=CHCHO. Présent naturellement sous forme principalement de l' isomère trans ( E ) , il donne à la cannelle sa saveur et son odeur . C'est un phénylpropanoïde qui est naturellement synthétisé par la voie du shikimate . Ce jaune pâle, visqueux liquide se produit dans l' écorce de cannelle arbres et d' autres espèces du genre Cinnamomum . L' huile essentielle d'écorce de cannelle contient environ 90 % de cinnamaldéhyde.
Structure et synthèse
Le cinnamaldéhyde a été isolé de l'huile essentielle de cannelle en 1834 par Jean-Baptiste Dumas et Eugène-Melchior Péligot et synthétisé en laboratoire par le chimiste italien Luigi Chiozza en 1854.
Le produit naturel est le trans- cinnamaldéhyde. La molécule est constituée d'un cycle benzénique attaché à un aldéhyde insaturé. En tant que telle, la molécule peut être considérée comme un dérivé de l' acroléine . Sa couleur est due à la transition π → π* : une conjugaison accrue par rapport à l'acroléine déplace cette bande vers le visible.
Biosynthèse
Le cinnamaldéhyde est largement répandu et des composés étroitement apparentés donnent naissance à la lignine . Tous ces composés sont biosynthétisés à partir de la phénylalanine , qui subit une conversion.
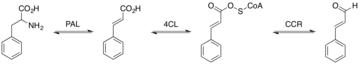
La biosynthèse du cinnamaldéhyde commence par la désamination de la L- phénylalanine en acide cinnamique par l'action de la phénylalanine ammonia lyase (PAL). PAL catalyse cette réaction par une désamination non oxydante. Cette désamination repose sur le groupe prothétique MIO de PAL. PAL donne lieu à trans- cinnamique. Dans la deuxième étape, la 4-coumarate-CoA ligase (4CL) convertit l'acide cinnamique en cinnamoyl-CoA par une ligature acide- thiol . 4CL utilise l'ATP pour catalyser la formation de cinnamoyl-CoA. 4CL effectue cette réaction en deux étapes. 4CL forme un anhydride hydroxycinnamate-AMP, suivi d'une attaque nucléophile sur le carbonyle de l'acyl adénylate. Enfin, le Cinnamoyl-CoA est réduit par le NADPH catalysé par la CCR (cinnamoyl-CoA réductase) pour former le cinnamaldéhyde.
Préparation
Plusieurs méthodes de synthèse en laboratoire existent, mais le cinnamaldéhyde est obtenu le plus économiquement à partir de la distillation à la vapeur de l'huile d'écorce de cannelle. Le composé peut être préparé à partir de composés apparentés tels que l'alcool cinnamylique (la forme alcoolique du cinnamaldéhyde), mais la première synthèse à partir de composés non apparentés était la condensation aldolique du benzaldéhyde et de l' acétaldéhyde ; ce procédé a été breveté par Henry Richmond le 7 novembre 1950.
Applications
Comme aromatisant
L'application la plus évidente du cinnamaldéhyde est comme aromatisant dans les chewing-gums , les glaces , les bonbons , les eliquides et les boissons ; les niveaux d'utilisation varient de 9 à 4 900 parties par million ( ppm ) (c'est-à-dire moins de 0,5 %). Il est également utilisé dans certains parfums de naturel, doux ou fruités parfums . Les arômes d' amande , d' abricot , de caramel au beurre et d'autres peuvent utiliser partiellement le composé pour leurs odeurs agréables. Le cinnamaldéhyde peut être utilisé comme adultérant alimentaire ; la cosse de faîne en poudre aromatisée au cinnamaldéhyde peut être commercialisée sous forme de poudre de cannelle . Certaines céréales pour petit-déjeuner contiennent jusqu'à 187 ppm de cinnamaldéhyde.
En tant qu'agrochimique
Le cinnamaldéhyde a été testé comme un insecticide sûr et efficace contre les larves de moustiques . Une concentration de 29 ppm de cinnamaldéhyde tue la moitié des larves de moustique Aedes aegypti en 24 heures. Le trans-cinnamaldéhyde agit comme un puissant fumigant et un répulsif pratique pour les moustiques adultes . Il possède également des propriétés antibactériennes et antifongiques .
Utilisations diverses
Le cinnamaldéhyde est un inhibiteur de corrosion pour l' acier et d'autres alliages . On pense qu'il forme un film protecteur sur la surface métallique.
Dérivés
De nombreux dérivés du cinnamaldéhyde sont commercialement utiles. L'alcool dihydrocinnamylique est présent naturellement mais est produit par double hydrogénation du cinnamaldéhyde. Il a les parfums de jacinthe et de lilas. L'alcool cinnamylique est également présent naturellement et a l'odeur du lilas mais peut également être produit à partir de cinnamaldéhyde. Le dihydrocinnamaldéhyde est produit par l'hydrogénation sélective de la sous-unité alcène. L'α-amylcinnamaldéhyde et l'-hexylcinnamaldéhyde sont des parfums commerciaux importants, mais ils ne sont pas préparés à partir de cinnamaldéhyde. L'hydrogénation du cinnamaldéhyde, si elle est dirigée vers l'alcène, donne l' hydrocinnamaldéhyde .
Toxicologie
Le cinnamaldéhyde est utilisé en agriculture en raison de sa faible toxicité, mais c'est un irritant cutané. L'allergie au cinnamaldéhyde n'est pas courante.