Toxine distendante cytolethale - Cytolethal distending toxin
| Toxine de distension cytolétale | |||||||||
|---|---|---|---|---|---|---|---|---|---|
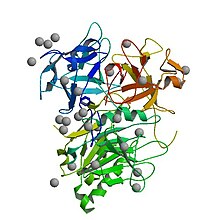 Structure cristalline de la toxine de distension cytolétale Haemophilus ducreyi entièrement assemblée
| |||||||||
| Identifiants | |||||||||
| symbole | CDT | ||||||||
| Pfam | PF03498 | ||||||||
| Clan Pfam | CL0066 | ||||||||
| InterPro | IPR003558 | ||||||||
| |||||||||
Cytolethal toxines de distension ( en abrégé des CDT ) sont une classe d' hétéro - trimériques toxines produites par certaines bactéries Gram-négatives qui affichent DNase activité. Ces toxines déclenchent l' arrêt du cycle cellulaire G2/M dans des lignées cellulaires de mammifères spécifiques, conduisant à des cellules agrandies ou distendues pour lesquelles ces toxines sont nommées. Les cellules affectées meurent par apoptose .
Chaque toxine se compose de trois sous - unités distinctes nommées par ordre alphabétique dans l' ordre d' apparition de leurs gènes codants dans l' opéron cdt . Les toxines de distension cytolétales sont classées comme des toxines AB , avec une sous-unité active ("A") qui endommage directement l'ADN et une sous-unité de liaison ("B") qui aide la toxine à se fixer aux cellules cibles. CdtB est la sous-unité active et un homologue de la DNase I de mammifère , tandis que CdtA et CdtC constituent la sous-unité de liaison.
Les toxines de distension cytolétales sont produites par des bactéries pathogènes à Gram négatif du phylum Proteobacteria . Beaucoup de ces bactéries, y compris Shigella dysenteriae , Haemophilus ducreyi et Escherichia coli , infectent les humains. Les bactéries qui produisent des CDT colonisent souvent de manière persistante leur hôte.
Histoire
La première observation enregistrée d'une toxine à distension cytolétale remonte à 1987 dans une souche pathogène d' E. coli isolée d'un jeune patient. Plus tard cette année-là, les scientifiques WM Johnson et H. Lior ont publié l'article de journal « Production de la toxine de Shiga et d'une toxine de distension cytolethale (CLDT) par les sérogroupes de Shigella spp. » dans Microbiology Letters . La découverte d'autres bactéries produisant des toxines CDT se poursuit à ce jour.
En 1994, deux scientifiques, Scott et Kaper, ont cloné et séquencé avec succès un opéron cdt d'une autre souche d' E. coli , publiant leurs réalisations dans Infection and Immunity . Les trois gènes découverts ont été notés cdtA , cdtB et cdtC .
En 1997, le premier article de plusieurs à montrer l'arrêt du cycle cellulaire G2/M causé par une toxine de distension cytolétale a été publié dans Molecular Microbiology . L'étude s'est concentrée sur une autre souche d' E. coli . Cet article a été suivi d'une publication de 1999 dans Infectious Immunity , qui démontrait que H. ducreyi CDT provoque la mort cellulaire par apoptose . Cette découverte a également été confirmée pour d'autres toxines de distension cytolétales dans des études ultérieures.
La découverte de l' homologie de cdtB avec la DNase I de mammifère et le modèle AB actuel pour la toxine ont été publiés au début de 2000. D'autres recherches et la publication de structures cristallines pour les toxines CDT de deux espèces différentes continuent de soutenir ce modèle.
Sources
Toutes les toxines de distension cytolétales connues sont produites par des bactéries gram-négatives des classes gamma et epsilon du phylum des Proteobacteria . Dans plusieurs cas, les bactéries productrices de CDT sont des agents pathogènes humains . Les producteurs de CDT médicalement importants comprennent :
- Haemophilus ducreyi ( chancre mou )
- Aggregatibacter actinomycetemcomitans ( parodontite )
- Escherichia coli (maladies diverses)
- Shigella dysenteriae ( dysenterie )
- Salmonella enterica sérotype Typhi ( fièvre typhoïde )
- Campylobacter upsaliensis ( entérocolite )
- Campylobacter jejuni (entérocolite)
Les bactéries productrices de CDT sont souvent associées aux muqueuses, telles que celles de l'estomac et des intestins, et à des infections persistantes. Les toxines sont soit sécrétées librement, soit associées à la membrane des bactéries productrices.
Nomenclature
Les toxines de distension cytolétales individuelles portent le nom de l'espèce bactérienne dont elles sont isolées. Depuis 2011, la plupart des scientifiques ont adopté la pratique consistant à placer la première lettre du genre et de l'espèce devant le nom de la toxine pour refléter sa source (c'est-à-dire que le CDT d' Haemaphilus ducreyi est appelé HdCDT). Si plusieurs sous-espèces produisent des toxines différentes, comme dans le cas d' E. coli , des chiffres romains peuvent être ajoutés après la deuxième lettre. Les toxines complètes et les sous-unités individuelles sont étiquetées selon cette convention.
En réponse à la découverte continue de toxines de distension cytolétales supplémentaires, un examen de 2011 a proposé que les noms des toxines soient élargis pour inclure les trois premières lettres de l'espèce (c.-à-d. HducCDT pour Haemaphilus ducreyi CDT).
Effets cellulaires
Les toxines CDT sont des génotoxines capables d'endommager directement l'ADN dans les cellules cibles. Ce sont les seules toxines de type AB découvertes qui présentent une activité DNase , leur permettant d'introduire des cassures dans l'ADN de la cellule cible.
Dans de nombreuses lignées cellulaires, y compris les fibroblastes humains , les cellules épithéliales , les cellules endothéliales et les kératinocytes , les CDT provoquent un arrêt du cycle cellulaire G2/M , une distension cytoplasmique et une éventuelle mort cellulaire par apoptose . La plupart des publications attribuent l'arrêt du cycle G2/M à l'accumulation de dommages irréversibles à l'ADN dus à l'activité DNase de la toxine comme déclencheur de l'arrêt du cycle cellulaire G2/M, mais d'autres recherches suggèrent que ce modèle est incomplet. La distension cytoplasmique est un résultat direct de l'arrêt du cycle cellulaire G2/M. La cellule s'agrandit en vue de la mitose , mais ne peut pas se diviser pour retrouver sa taille normale. Outre l'apoptose classique, des signes de sénescence cellulaire ont également été observés dans des lignées cellulaires normales et cancéreuses (fibroblastes, HeLa et U2-OS) après intoxication par CDT
Dans les lymphocytes , la mort cellulaire survient rapidement et n'est pas précédée d'une distension cytoplasmique importante. La capacité de ces toxines à affecter différemment les lymphocytes peut être avantageuse pour les bactéries qui utilisent ces toxines, mais le mécanisme derrière ce phénomène n'est pas encore bien compris.
Structure de la toxine
La toxine active et assemblée est une structure tripartite avec trois sous-unités distinctes - CdtA, CdtB et CdtC. En termes de fonction, c'est une toxine AB . Dans ce contexte, la sous-unité CdtB est en fait la sous-unité "A" catalytiquement active, et CdtA et CdtC forment ensemble la sous-unité "B" de liaison, qui aide la toxine à se lier et à pénétrer dans les cellules cibles. Certains documents se réfère à la structure de la toxine comme AB 2 pour refléter la présence des deux CDTA et CDTC.
Différent de tous les autres CDT , Salmonella enterica sérovar Typhi CDT (SeCDT) n'a pas d'homologues CdtA et CdtC. Cependant, codées étroitement à la sous-unité active cdtb , les toxines A et B de type coquelucheux (pltA/pltB) se sont avérées essentielles pour l'intoxication cellulaire. PltA et PltB ont une structure différente de CdtA et CdtC, favorisant ainsi l'activité de CdtB d'une manière différente. PltA et PltB se sont avérés se lier directement au CdtB in vitro . De plus, à la différence de tous les autres CDT, la génotoxine de Salmonella n'est produite que lors de l'internalisation bactérienne dans les cellules infectées.
CDtB
Le CdtB est considéré comme la sous-unité active de l'holotoxine CDT. La microinjection de CdtB dans des cellules sensibles sans CdtA ou CdtC entraîne l'arrêt du cycle cellulaire G2/M et la distension cytoplasmique caractéristique des toxines CDT. La structure de CdtB est bien conservée entre différentes bactéries. La sous-unité CdtB est la plus séquentiellement conservée entre les espèces. Le poids moléculaire du CdtB varie de 28 kDa à 29 kDa, selon les espèces.
En tant que sous-unité active, CdtB est appelée sous-unité "A" selon le modèle de toxine AB . Cette nomenclature confuse est due à la désignation des sous-unités de la toxine avant que leurs fonctions individuelles ne soient comprises.
Activité
CdtB présente au moins deux activités enzymatiques : une activité DNase capable d'introduire des cassures double brin dans l'ADN, et une activité phosphatase qui ressemble à la phosphatidylinositol 3,4,5-triphosphatase. Les deux activités peuvent être démontrées in vitro en l'absence des deux autres sous-unités. L'importance relative de chaque activité in vivo n'est pas claire. Les mutations qui réduisent l'une ou l'autre activité réduisent également la capacité de la toxine à induire un arrêt de phase G2/M dans au moins certaines des lignées cellulaires sensibles .
Similitudes avec la DNase I de mammifère
CdtB est fonctionnellement homologue à des mammifères DNase I et contient un Conservée penta peptide séquence trouvée dans toutes les enzymes DNase I à ce jour. De plus, plusieurs résidus essentiels à la capacité de la DNase I à rompre les liaisons phosphodiester dans le squelette de l'ADN se trouvent dans la structure CdtB. Un article de 2002 étudiant l'effet des mutations ponctuelles sur cinq de ces résidus a révélé que quatre des cinq mutations testées abolissaient à la fois la capacité de CdtB à dégrader l'ADN dans des extraits acellulaires et à provoquer un arrêt G2/M lors de la microinjection. La cinquième mutation a modérément réduit l'activité de CdtB.
CdtA et CdtC
CdtA et CdtC constituent la sous-unité B de l'holotoxine CDT responsable du ciblage du CdtB contre les cellules sensibles. Aucune des deux sous-unités ne semble hautement conservée, avec des identités de séquences entre différentes espèces souvent inférieures à 30 %. Le poids moléculaire du CdtA varie de 23 kDa à 30 kDa, tandis que le CdtC varie de 19 kDa à 21 kDa selon les espèces.
Activité
On pense que CdtA et CdtC se lient à la surface des cellules cibles. Le mécanisme exact de cette liaison n'est pas clair et peut ne pas être conservé entre les toxines CDT de différentes espèces. Les cibles proposées de la liaison CdtA et CdtC comprenaient le cholestérol, les glycanes N-liés et les glycosphingolipides. La recherche actuelle a produit des résultats contradictoires sur l'importance réelle de ces cibles proposées. CdtA et CdtC contiennent tous deux des domaines de lectine, ce qui suggère que la toxine peut se lier via des glucides à la surface de la cellule cible, alors que d'autres recherches ont suggéré que les cibles sont des protéines de surface.
