Décarbonylation - Decarbonylation
La décarbonylation est un type de réaction organique qui implique une perte de CO. Il s'agit souvent d'une réaction indésirable car elle représente une dégradation. Dans la chimie des carbonyles métalliques , la décarbonylation décrit un processus de substitution, dans lequel un ligand CO est remplacé par un autre ligand.
Chimie organique
En l'absence de catalyseurs métalliques, la décarbonylation (vs la décarboxylation) est rarement observée en chimie organique. Une exception est la décarbonylation de l'acide formique :
- HCO 2 H → CO + H 2 O
La réaction est induite par l'acide sulfurique , qui fonctionne à la fois comme catalyseur et comme agent déshydratant. Par cette réaction, l'acide formique est parfois utilisé comme source de CO dans le laboratoire à la place de bouteilles de ce gaz toxique. Avec un fort chauffage, l'acide formique et certains de ses dérivés peuvent subir une décarbonylation, même sans ajout de catalyseur. Par exemple, le diméthylformamide se décompose lentement pour donner de la diméthylamine et du monoxyde de carbone lorsqu'il est chauffé à son point d'ébullition (154 ° C). Certains dérivés de l'acide formique, comme le chlorure de formyle , subissent une décarbonylation spontanée à température ambiante (ou en dessous).
Les réactions impliquant le chlorure d'oxalyle (COCl) 2 (par exemple, hydrolyse, réaction avec des acides carboxyliques, oxydation de Swern , etc.) libèrent souvent à la fois du dioxyde de carbone et du monoxyde de carbone via un processus de fragmentation.
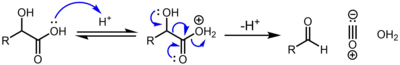
Les α-hydroxyacides , par exemple ( acide lactique et acide glycolique ) subissent une décarbonylation lorsqu'ils sont traités avec de l'acide sulfurique concentré catalytique, par le mécanisme suivant:
Les acides silacarboxyliques (R 3 SiCOOH) subissent une décarbonylation par chauffage ou traitement avec une base et ont été étudiés en tant que molécules générant du monoxyde de carbone.
Décarbonylation d'aldéhyde
Une transformation courante implique la conversion d' aldéhydes en alcanes .
- RCHO → RH + CO
La décarbonylation peut être catalysée par des complexes métalliques solubles. Ces réactions se déroulent par l'intermédiaire d' hydrures d'acyle métalliques . Un exemple de ceci est la réaction de décarbonylation Tsuji – Wilkinson utilisant le catalyseur de Wilkinson . (Strictement parlant, la version non catalytique de cette réaction conduit à la formation d'un complexe rhodium carbonyle plutôt que de monoxyde de carbone libre.) Cette réaction est généralement réalisée à petite échelle au cours d'une synthèse totale de produit naturel complexe, car bien que cette réaction est très efficace à des températures légèrement élevées (par exemple 80 ° C) lorsque du rhodium stoechiométrique est utilisé, le renouvellement du catalyseur par extrusion de CO nécessite la dissociation d'un complexe de rhodium carbonyle très stable et des températures supérieures à 200 ° C sont nécessaires. Cette conversion est intéressante en synthèse organique , où la décarbonylation est une réaction par ailleurs rare.
Les décarbonylations sont intéressantes dans les conversions de sucres. Les cétones et autres groupes fonctionnels contenant du carbonyle sont plus résistants à la décarbonylation que les aldéhydes.
Réactions péricycliques
Certaines molécules cycliques contenant une cétone subissent une réaction d'extrusion chélétropique , laissant de nouvelles liaisons carbone-carbone π sur la structure restante. Cette réaction peut être spontanée, comme dans la synthèse de l' hexaphénylbenzène . Les cyclopropénones et cyclobutènediones peuvent être converties en alcynes par élimination d'une ou deux molécules de CO, respectivement.
Biochimie
Le monoxyde de carbone est libéré lors de la dégradation (catabolisme) de l'hème par l'action de l'O 2 , du NADPH et de l'enzyme hème oxygénase :
- Heme b + 3 O 2 + 3 1 / 2 NADPH + 3 1 / 2 H + → biliverdine + Fe 2+ + CO + 3 1 / 2 NADP + + 3H 2 O
Synthèse inorganique et organométallique
De nombreux carbonyles métalliques sont préparés par des réactions de décarbonylation. Le ligand CO du complexe de Vaska provient de la décarbonylation du DMF :
- IrCl 3 (H 2 O) 3 + 3 P (C 6 H 5 ) 3 + HCON (CH 3 ) 2 + C 6 H 5 NH 2 → IrCl (CO) [P (C 6 H 5 ) 3 ] 2 + [ (CH 3 ) 2 NH 2 ] Cl + OP (C 6 H 5 ) 3 + [C 6 H 5 NH 3 ] Cl + 2 H 2 O
La conversion de Fe (CO) 5 et Mo (CO) 6 en leurs nombreux dérivés implique souvent une décarbonylation. Ici, la décarbonylation accompagne la préparation du cyclopentadiényliron dicarbonyl dimère :
- 2 Fe (CO) 5 + C 10 H 12 → ( η 5 -C 5 H 5 ) 2 Fe 2 (CO) 4 + 6 CO + H 2
La décarbonylation peut être induite photochimiquement ainsi que l'utilisation de réactifs tels que le N -oxyde de triméthylamine :
- Me 3 NO + L + Fe (CO) 5 → Me 3 N + CO 2 + LFe (CO) 4