Épimorphose - Epimorphosis
L'épimorphose est définie comme la régénération d'une partie spécifique d'un organisme d'une manière qui implique une prolifération cellulaire étendue de cellules souches somatiques, une dédifférenciation et une reformation, ainsi qu'une formation de blastème . L'épimorphose peut être considérée comme un modèle simple de développement , bien qu'elle ne se produise que dans les tissus entourant le site de la lésion plutôt que de se produire à l'échelle du système. L'épimorphose restaure l'anatomie de l'organisme et la polarité originelle qui existait avant la destruction du tissu et/ou d'une structure de l'organisme. La régénération de l'épimorphose peut être observée chez les vertébrés et les invertébrés tels que les exemples courants : salamandres, annélides et planaires.
Histoire
Thomas Hunt Morgan , un biologiste évolutionniste qui a également travaillé avec l'embryologie, a soutenu que la reformation des membres et des tissus présentait de nombreuses similitudes avec le développement embryonnaire. S'appuyant sur les travaux de l'embryologiste allemand Wilhelm Roux , qui a suggéré que la régénération était deux voies coopératives mais distinctes au lieu d'une, Morgan a nommé les deux parties du processus de régénération épimorphose et morphallaxe . Plus précisément, Morgan voulait que l'épimorphose spécifie le processus de repousse de tissus entièrement nouveaux à la suite d'une amputation ou d'une blessure similaire, la morphallaxe étant inventée pour décrire la régénération qui n'utilisait pas la prolifération cellulaire , comme dans l' hydre . le différence clé entre les deux formes de régénération est que l'épimorphose implique la prolifération cellulaire et la formation de blastème, contrairement à la morphallaxe.
Chez les vertébrés
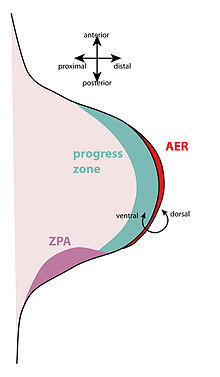

Chez les vertébrés , l'épimorphose repose sur la formation de blastèmes pour faire proliférer les cellules dans le nouveau tissu. Grâce à des études impliquant des nageoires de poisson zèbre , le bout des orteils de souris et la régénération des membres chez les axolotls , des chercheurs de l' Académie polonaise des sciences ont trouvé des preuves d'épimorphose survenant chez une variété de vertébrés, y compris des cas d'épimorphose de mammifères.
Régénération des membres
La régénération des membres se produit lorsqu'une partie d'un organisme est détruite et que l'organisme doit reformer cette structure. Les étapes générales de la régénération du membre sont les suivantes : l'épiderme recouvre la plaie qui s'appelle le processus de cicatrisation, le mésenchyme se dédifférencie en un blastème et une coiffe ectodermique apicale se forme, et le membre se redifférencie pour former le membre complet.
Processus chez les salamandres
Les cellules épidermiques des bords de la plaie migrent pour recouvrir la plaie et deviendront l'épiderme de la plaie. Aucun tissu cicatriciel ne se forme, comme ce serait le cas chez les mammifères. Les tissus mésenchymateux du moignon du membre sécrètent des métalloprotéinases matricielles (MMP). Au fur et à mesure que les MMP sont sécrétées, l'épithélium de la plaie s'épaissit et finit par devenir une coiffe ectodermique apicale (AEC) qui se forme à l'extrémité du moignon. Ceci est similaire à la crête ectodermique apicale embryonnaire , qui se forme au cours du développement normal des membres . Sous l'AEC, les nerfs proches du site du membre détruit sont dégradés. L'AEC provoque le rétablissement de la zone de progression ; cela signifie que les cellules sous l'AEC (y compris les cellules osseuses, cartilagineuses, fibroblastiques, etc.) se dédifférencient et deviennent des cellules mésenchymateuses séparées qui forment le blastème. Certains tissus expriment des gènes spécialisés (comme les cellules musculaires) et donc s'il y a des dommages à ces tissus, les gènes deviennent régulés à la baisse et les gènes de prolifération ne sont pas régulés. L'AEC libère également des facteurs de croissance des fibroblastes (FGF) (y compris FGF-4 et -8 ) qui entraînent le développement du nouveau membre, réinitialisant essentiellement le membre à son stade de développement embryonnaire. Cependant, même si certaines des cellules des membres sont capables de se dédifférencier, elles ne sont pas capables de se dédifférencier complètement au niveau des cellules progénitrices multipotentes . Pendant la régénération, seules les cellules cartilagineuses peuvent former un nouveau tissu cartilagineux, seules les cellules musculaires peuvent former un nouveau tissu musculaire, etc. Les cellules dédifférenciées conservent toujours leur spécification d' origine . Pour commencer la formation physique d'un nouveau membre, la régénération se produit dans une séquence distale à proximale. La partie distale du membre est établie en premier, puis la partie distale du membre interagit avec la partie proximale d'origine du membre pour former la partie intermédiaire du membre appelée intercalation.
Chez les invertébrés
Periplaneta americana
La blatte américaine est capable de régénérer les membres qui ont été endommagés ou détruits, tels que les pattes et les antennes, ainsi que des parties de son œil composé. Il le fait avec la lectine, une protéine conçue pour lier des protéines, appelée régénéctine , qui partage une famille avec d'autres protéines de liaison aux lipopolysaccharides (LPS) . La régenectine a à la fois une fonction régénératrice et une fonction de défense du système, et elle est produite par le système paracrine de la blatte pour travailler avec la reformation musculaire.
Capitelle téléta
C. teleta est un ver segmenté trouvé en Amérique du Nord qui est capable de régénérer les segments postérieurs après amputation. Cette régénération utilise l'interaction de plusieurs ensembles degènes Hox , ainsi que la formation de blastème. Tous lesgènes Hox concernés dans l'épimorphose sont présents dans la région abdominale du ver, mais pas dans la partie antérieure. Cependant, les gènes ne dirigent pas eux-mêmes la structuration antéro-postérieure du thorax du ver.
Planaire vitta
P. vitta est un ver plat du genre Planaria qui, en cas de besoin, peut s'appuyer à la fois sur la morphallaxe et l'épimorphose pour se régénérer ; chez P. vitta, l' épimorphose précède la morphallaxe et dure une dizaine de jours. Les planaires commencent l'épimorphose par lacontractionde l' épiderme immédiatement après que le ver a été coupé à la tête en tant que mécanisme de réaction prédateur afin de diminuer la surface au site de la coupe. Ce mécanisme active les néoblastes qui sont descellulessouches totipotentes , ce qui permet aux rhabdites de sécréter des matériaux pour former un revêtement muqueux protecteur et l'épithélium de se rassembler sur le site par la propagation des cellules plutôt que la prolifération qui se produit chez les vertébrés Les cellules épithéliales dorsales et ventrales viennent alors à le site et se différencier pour commencer la régénération. La polarité des planaires peut être rétablie par un gradient antéro-postérieur via la voie de signalisation Wnt/β-caténine. La polarité peut être décrite chez les planaires selon laquelle la partie antérieure du site de la plaie créera une tête de planaire et le côté postérieur créera la queue.
