Réaction de Henry - Henry reaction
| Réaction de Henry | |
|---|---|
| Nommé après | Louis Henry |
| Type de réaction | Réaction de couplage |
| Identifiants | |
| Portail de la chimie organique | réaction de Henry |
| ID d'ontologie RSC | RXNO: 0000086 |
La réaction de Henry est une réaction classique de formation de liaisons carbone-carbone en chimie organique . Découvert en 1895 par le chimiste belge Louis Henry (1834–1913), il s'agit de l'association d'un nitroalcane et d'un aldéhyde ou cétone en présence d'une base pour former des β-nitro alcools. Ce type de réaction est également appelé réaction de nitroaldol (nitroalcane, aldéhyde et alcool). Il est presque analogue à la réaction d'aldol qui avait été découverte 23 ans auparavant qui couple deux composés carbonylés pour former des composés β-hydroxy carbonylés appelés «aldols» (aldéhyde et alcool). La réaction de Henry est une technique utile dans le domaine de la chimie organique en raison de l'utilité synthétique de ses produits correspondants, car ils peuvent être facilement convertis en d'autres intermédiaires synthétiques utiles. Ces conversions comprennent une déshydratation ultérieure pour donner des nitroalcènes , une oxydation de l'alcool secondaire pour donner des a-nitro cétones, ou une réduction du groupe nitro pour donner des ß-amino alcools.
Beaucoup de ces utilisations ont été illustrées dans la synthèse de divers produits pharmaceutiques, y compris le bêtabloquant ( S ) -propranolol , l'inhibiteur de la protéase du VIH Amprenavir (Vertex 478) et la construction de la sous-unité glucidique de la classe d'antibiotiques anthracycline, la L-acosamine. . Le schéma de synthèse de la synthèse de la L-acosamine peut être trouvé dans la section Exemples de cet article.
Mécanisme
La réaction de Henry commence par la déprotonation du nitroalcane en position α-carbone formant un nitronate . Le pKa de la plupart des nitroalcanes est d'environ 17. Bien que cette structure soit nucléophile à la fois au niveau du carbone déprotoné et aux oxy-anions du groupe nitro, le résultat observé est que le carbone attaque le composé carbonyle. Le ß-nitroalcoxyde résultant est protoné par l'acide conjugué de la base qui a initialement déprotoné la structure nitroalkyle, donnant le ß-nitro alcool respectif comme produit.
Il est important de noter que toutes les étapes de la réaction de Henry sont réversibles. Cela est dû à l'absence d'une étape engagée dans la réaction pour former le produit. C'est pour cette raison que la recherche a été orientée vers des modifications pour conduire la réaction à son terme. Vous trouverez plus d'informations à ce sujet dans la section modification de cet article.
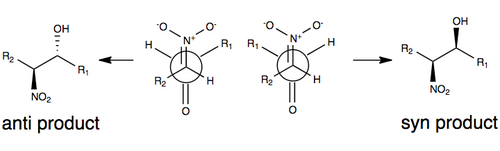
Cours de stéréochimie
La figure ci-dessous illustre l'un des modèles communément acceptés pour la stéréosélection sans aucune modification de la réaction de Henry. Dans ce modèle, la stéréosélectivité est régie par la taille des groupes R dans le modèle (comme une chaîne carbonée), ainsi que par un état de transition qui minimise le dipôle en orientant le groupe nitro et l'oxygène carbonyle l'un contre l'autre (sur les côtés opposés de la molécule). Les groupes R jouent un rôle dans l'état de transition de la réaction de Henry: plus les groupes R sont grands sur chacun des substrats, plus ils auront tendance à s'éloigner les uns des autres (communément appelés effets stériques ).
En raison de la réversibilité de la réaction et de la tendance à une épimérisation facile de l'atome de carbone nitro-substitué (parmi un certain nombre de facteurs), la réaction de Henry produira typiquement un mélange d' énantiomères ou de diastéréoisomères . C'est pour cette raison que les explications de la stéréosélectivité restent rares sans une certaine modification de la réaction. Ces dernières années, la recherche s'est orientée vers des modifications de la réaction de Henry pour surmonter ce défi synthétique.
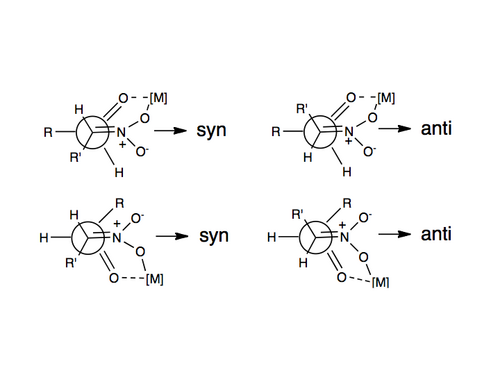
Le premier exemple d'une réaction énantiosélective de nitroaldol a été rapporté en 1992 en utilisant des catalyseurs de Shibasaki . L'un des procédés les plus fréquemment employés pour induire une énantio- ou diastéréosélectivité dans la réaction de Henry est l'utilisation de catalyseurs métalliques chiraux, dans lesquels le groupe nitro et l'oxygène carbonyle se coordonnent à un métal qui est lié à une molécule organique chirale. Certains métaux qui ont été utilisés comprennent le zinc, le cobalt, le cuivre, le magnésium et le chrome. Une représentation de cette coordination est illustrée ci-dessus.
Caractéristiques générales
L'une des nombreuses caractéristiques de la réaction de Henry qui la rend synthétiquement attractive est qu'elle n'utilise qu'une quantité catalytique de base pour conduire la réaction. De plus, une variété de bases peut être utilisée, y compris des bases ioniques telles que des hydroxydes de métaux alcalins, des alcoolates, des carbonates et des sources d'anion fluorure (par exemple TBAF) ou des bases amines organiques non ioniques comprenant TMG, DBU, DBN et PAP. Il est important de noter que la base et le solvant utilisés n'ont pas une grande influence sur le résultat global de la réaction.
Limites
L'un des principaux inconvénients de la réaction de Henry est le potentiel de réactions secondaires partout. Outre la réversibilité inhérente à la réaction (ou «rétro-Henry») qui peut empêcher la réaction de se dérouler, le β-nitro-alcool a également le potentiel de subir une déshydratation. Pour les substrats stériquement encombrés, il est également possible qu'une auto-condensation catalysée par une base ( réaction de Cannizzaro ) se produise. Un schéma général de la réaction de Cannizzaro est décrit ci-dessous.
Modifications
Une série de modifications ont été apportées à la réaction de Henry. Parmi ceux-ci, certains des plus importants comprennent l'utilisation de conditions à haute pression et parfois sans solvant pour améliorer la chimio et la régiosélectivité et les catalyseurs métalliques chiraux pour induire une énantio ou diastéréosélectivité. La réaction aza-Henry est également utilisée pour produire des nitroamines et peut être une voie de synthèse fiable pour la synthèse de diamines vicinales.
L'une des modifications les plus synthétiquement utiles de la réaction de Henry est peut-être l'utilisation d'un organocatalyseur . Le cycle catalytique est illustré ci-dessous.
List a décrit que bien qu'il s'agisse d'une explication large, sa brève revue montre qu'il s'agit d'une explication mécaniste plausible pour presque toutes les réactions qui impliquent un organocatalyseur. Un exemple de ce type de réaction est illustré dans la section Exemples de cet article.
En plus des modifications précédemment mentionnées de la réaction de Henry, il en existe une variété d'autres. Cela comprend la conversion des composés alkyl nitro non réactifs en leurs dianions correspondants qui réagiront plus rapidement avec les substrats carbonyle, les réactions peuvent être accélérées en utilisant PAP comme base, l'utilisation de la réactivité des aldéhydes avec des nitroalcanes α, α-doublement déprotonés pour donner des alcoxydes de nitronate qui donnent principalement des alcools syn-nitro une fois protonés, et enfin la génération d'anions nitronate dans lesquels un atome d'oxygène sur le groupe nitro est protégé par un silyle pour donner des alcools anti-β-nitro en présence d'une source d'anion fluorure lors de la réaction avec un aldéhyde.
Exemples
Application industrielle - En 1999, Menzel et ses collègues ont développé une voie synthétique pour obtenir la L - acosamine , la sous-unité glucidique de la classe d'antibiotiques anthracycline :
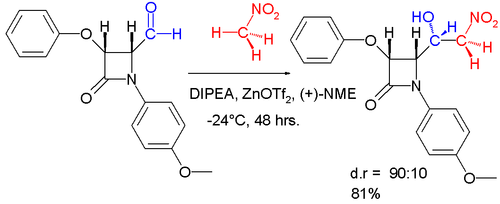
Application industrielle - Un produit d'addition aldol énantiosélective peut être obtenu en synthèse asymétrique par réaction de benzaldéhyde avec du nitrométhane et un système de catalyseur constitué de triflate de zinc en tant qu'acide de Lewis , de diisopropyléthylamine (DIPEA) et de N- méthyléphédrine (NME) en tant que ligand chiral .
Une variation diastéréosélective de cette réaction est représentée ci-dessous.
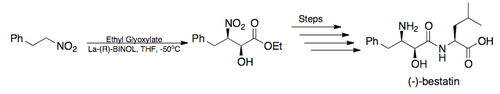
Synthèse totale - En 2005, Barua et ses collègues ont terminé la synthèse totale du puissant inhibiteur de l'aminopeptidase, (-) - bestatine, avec un rendement global de 26% de rendement global en utilisant la réaction asymétrique de Henry de Shibasaki comme étape clé. (illustré ci-dessous)
Organocatalyse - En 2006, Hiemstra et ses collaborateurs ont exploré l'utilisation de dérivés de quinine comme catalyseurs asymétriques pour la réaction entre les aldéhydes aromatiques et le nitrométhane. Grâce à l'utilisation de dérivés particuliers, ils ont pu induire une énantiosélection directe grâce à l'utilisation du catalyseur approprié.
Biocatalyse - En 2006, Purkarthofer et al. ont découvert que la ( S ) -hydroxynitrile lyase d' Hevea brasiliensis catalyse la formation d' alcools ( S ) -β-nitro. En 2011, Fuhshuku et Asano ont montré que l' hydroxynitrile lyase sélective ( R ) d' Arabidopsis thaliana pouvait catalyser la synthèse d' alcools ( R ) -β-nitro à partir de nitrométhane et d'aldéhydes aromatiques.
Les références
Liens externes
-
 Médias liés à la catégorie: Réaction de Henry sur Wikimedia Commons
Médias liés à la catégorie: Réaction de Henry sur Wikimedia Commons