Isoquinoléine - Isoquinoline

|
|||
|
|
|||
| Noms | |||
|---|---|---|---|
|
Nom IUPAC préféré
Isoquinoléine |
|||
| Autres noms
Benzo[ c ]pyridine
2-benzazine |
|||
| Identifiants | |||
|
Modèle 3D ( JSmol )
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Banque de médicaments | |||
| Carte d'information de l'ECHA |
100.003.947 |
||
| Numéro CE | |||
|
CID PubChem
|
|||
| UNII | |||
|
Tableau de bord CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriétés | |||
| C 9 H 7 N | |||
| Masse molaire | 129,162 g·mol -1 | ||
| Apparence | Liquide huileux incolore; plaquettes hygroscopiques à l'état solide | ||
| Densité | 1,099 g / cm 3 | ||
| Point de fusion | 26-28 °C (79-82 °F; 299-301 K) | ||
| Point d'ébullition | 242 °C (468 °F; 515 K) | ||
| Acidité (p K a ) | pK BH + = 5,14 | ||
| −83,9·10 −6 cm 3 /mol | |||
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Références de l'infobox | |||
L'isoquinoléine est un composé organique aromatique hétérocyclique . C'est un isomère structurel de la quinoléine . L'isoquinoléine et la quinoléine sont des benzopyridines , qui sont composées d'un cycle benzénique fusionné à un cycle pyridine . Dans un sens plus large, le terme isoquinoléine est utilisé pour faire référence aux dérivés de l' isoquinoléine . La 1-benzylisoquinoléine est l'épine dorsale structurelle des alcaloïdes naturels, y compris la papavérine . Le cycle isoquinoléine de ces composés naturels dérive de la tyrosine, un acide aminé aromatique .
Propriétés
L'isoquinoléine est un liquide hygroscopique incolore à des températures supérieures à son point de fusion avec une odeur pénétrante et désagréable . Les échantillons impurs peuvent apparaître brunâtres, ce qui est typique pour les hétérocycles azotés. Il cristallise en plaquettes qui ont une faible solubilité dans l'eau mais se dissolvent bien dans l' éthanol , l' acétone , l'éther diéthylique , le sulfure de carbone et d'autres solvants organiques courants . Il est également soluble dans les acides dilués en tant que dérivé protoné.
Étant un analogue de la pyridine, l'isoquinoléine est une base faible , avec un p K a de 5,14. Il se protone pour former des sels lors du traitement avec des acides forts , tels que HCl. Il forme des adduits avec les acides de Lewis , tels que BF 3 .
Production
L'isoquinoléine a été isolée pour la première fois du goudron de houille en 1885 par Hoogewerf et van Dorp. Ils l'ont isolé par cristallisation fractionnée du sulfate acide. Weissgerber a développé une route plus rapide en 1914 par extraction sélective du goudron de houille, exploitant le fait que l'isoquinoléine est plus basique que la quinoléine. L'isoquinoléine peut ensuite être isolée du mélange par cristallisation fractionnée du sulfate acide.
Bien que les dérivés d'isoquinoléine puissent être synthétisés par plusieurs méthodes, relativement peu de méthodes directes délivrent l'isoquinoléine non substituée. La réaction de Pomeranz-Fritsch fournit une méthode efficace pour la préparation de l'isoquinoléine. Cette réaction utilise un benzaldéhyde et un aminoacétoaldéhyde diéthyl acétal qui réagissent en milieu acide pour former de l'isoquinoléine. Alternativement, la benzylamine et un acétal de glyoxal peuvent être utilisés, pour produire le même résultat en utilisant la modification de Schlittler-Müller.
Plusieurs autres procédés sont utiles pour la préparation de divers dérivés d'isoquinoléine.
Dans la réaction de Bischler-Napieralski d' un β- phényléthylamine est acylé et cyclodehydrated par un acide de Lewis tel que le chlorure de phosphoryle ou du pentoxyde de phosphore . La 3,4-dihydroisoquinoléine 1-substituée résultante peut ensuite être déshydrogénée en utilisant du palladium. La réaction de Bischler-Napieralski suivante produit de la papavérine.
La réaction de Pictet-Gams et la réaction de Pictet-Spengler sont toutes deux des variantes de la réaction de Bischler-Napieralski. Une réaction de Pictet-Gams fonctionne de manière similaire à la réaction de Bischler-Napieralski ; la seule différence étant qu'un groupe hydroxy supplémentaire dans le réactif fournit un site de déshydratation dans les mêmes conditions de réaction que la cyclisation pour donner l'isoquinoléine plutôt que de nécessiter une réaction séparée pour convertir un intermédiaire dihydroisoquinoléine.
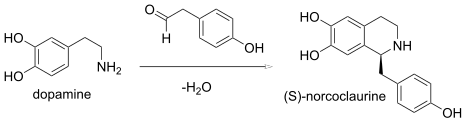
Dans une réaction de Pictet-Spengler , une condensation d'une -phényléthylamine et d'un aldéhyde forme une imine, qui subit une cyclisation pour former une tétrahydroisoquinoléine au lieu de la dihydroisoquinoléine . En enzymologie , la (S) -norcoclaurine synthase ( EC 4.2.1.78 ) est une enzyme qui catalyse une synthèse biologique de Pictect-Spengler :
Les réactions intramoléculaires d'aza Wittig donnent également des isoquinoléines.
Applications des dérivés
Les isoquinoléines trouvent de nombreuses applications, notamment :
- anesthésiques; la diméthisoquine en est un exemple (illustré ci-dessous).
- des agents antihypertenseurs, tels que le quinapril et la débrisoquine (tous dérivés de la 1,2,3,4-tétrahydroisoquinoléine).
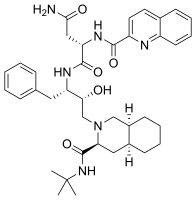
- les agents antirétroviraux, tels que le saquinavir avec un groupe fonctionnel isoquinolyle (illustré ci-dessous).
- vasodilatateurs, un exemple bien connu, la papavérine , illustré ci-dessous.
Les composés de bisbenzylisoquinolinium sont des composés de structure similaire à la tubocurarine . Ils ont deux structures isoquinolinium, liées par une chaîne carbonée , contenant deux liaisons ester .
Dans le corps humain
On pense que la maladie de Parkinson , un trouble du mouvement à évolution lente, est causée par certaines neurotoxines . Une neurotoxine appelée MPTP (1[ N ]-méthyl-4-phényl-1,2,3,6- tétrahydropyridine ), précurseur du MPP + , a été découverte et liée à la maladie de Parkinson dans les années 1980. Les neurotoxines actives détruisent les neurones dopaminergiques , entraînant le parkinsonisme et la maladie de Parkinson. Plusieurs dérivés de la tétrahydroisoquinoléine ont les mêmes propriétés neurochimiques que le MPTP. Ces dérivés peuvent agir comme précurseurs de neurotoxines actives.
Autres utilisations
Les isoquinoléines sont utilisées dans la fabrication de colorants , de peintures , d' insecticides et d' antifongiques . Il est également utilisé comme solvant pour l' extraction de résines et de terpènes , et comme inhibiteur de corrosion .
Voir également
- Naphtalène , un analogue sans l'atome d'azote.
Les références
Liens externes
. Encyclopédie Britannica . 22 (11e éd.). 1911. p. 758-759.