Bis(triméthylsilyl)amide de lithium - Lithium bis(trimethylsilyl)amide
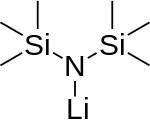 Monomère (n'existe pas)
|
|
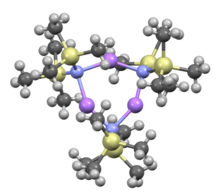
 Trimètre cyclique
|
|
|
|
| Noms | |
|---|---|
|
Nom IUPAC préféré
Lithium 1,1,1-triméthyl- N -(triméthylsilyl)silanaminide |
|
| Autres noms
Lithium hexaméthyldisilazide
sel de lithium hexaméthyldisilazane |
|
| Identifiants | |
|
Modèle 3D ( JSmol )
|
|
| ChemSpider | |
| Carte d'information de l'ECHA |
100.021.569 |
|
CID PubChem
|
|
| UNII | |
|
Tableau de bord CompTox ( EPA )
|
|
|
|
|
|
| Propriétés | |
| C 6 H 18 LiNSi 2 | |
| Masse molaire | 167,326 g/mol |
| Apparence | Solide blanc |
| Densité | 0,86 g / cm 3 à 25 ° C |
| Point de fusion | 71 à 72 °C (160 à 162 °F ; 344 à 345 K) |
| Point d'ébullition | 80 à 84 °C (176 à 183 °F ; 353 à 357 K) (0,001 mm Hg) |
| se décompose | |
| Solubilité | La plupart des solvants aprotiques THF , hexane , toluène |
| Acidité (p K a ) | 26 |
| Dangers | |
| Principaux dangers | inflammable, corrosif |
| Composés apparentés | |
|
Composés apparentés
|
Bis(triméthylsilyl)amide de sodium Bis(triméthylsilyl)amide de potassium |
|
Sauf indication contraire, les données sont données pour les matériaux dans leur état standard (à 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Références de l'infobox | |
Le lithium bis(triméthylsilyl)amide est un composé organosilicié lithié de formule LiN(SiMe 3 ) 2 . Il est généralement abrégé en tant que LiHMDS ( li thium h exa m éthyle d i s ilazide - une référence à son acide conjugué HMDS ) et est principalement utilisé comme une forte base non-nucléophile et en tant que ligand . Comme de nombreux réactifs au lithium, il a tendance à s'agréger et formera un trimère cyclique en l'absence d'espèce coordinatrice.
Préparation
Le LiHMDS est disponible dans le commerce, mais il peut également être préparé par déprotonation de bis(triméthylsilyl)amine avec du n-butyllithium . Cette réaction peut être réalisée in situ .
- HN(SiMe 3 ) 2 + C 4 H 9 Li → LiN(SiMe 3 ) 2 + C 4 H 10
Une fois formé, le composé peut être purifié par sublimation ou distillation .
Réactions et applications
Comme base
Le LiHMDS est souvent utilisé en chimie organique comme base forte non nucléophile . Son acide conjugué a un pKa de ~26, ce qui le rend moins basique que les autres bases lithium, comme le LDA (pKa de l'acide conjugué ~36), mais il est plus encombré stériquement et donc moins nucléophile . Il peut être utilisé pour former divers composés organolithiens , notamment des acétylures ou des énolates de lithium .
En tant que tel, il trouve une utilisation dans une gamme de réactions de couplage, en particulier des réactions de formation de liaisons carbone-carbone telles que l' alkylation de Fráter-Seebach et les condensations mixtes de Claisen .
Une synthèse alternative de tétrasulfure tétranitrure implique l'utilisation de [(Me 3 Si) 2 N] 2 S comme précurseur avec des liaisons S–N préformées. Le [(Me 3 Si) 2 N] 2 S est préparé par réaction de bis(triméthylsilyl)amide de lithium et de dichlorure de soufre (SCl 2 ).
- 2 [(CH 3 ) 3 Si] 2 NLi + SCl 2 → [((CH 3 ) 3 Si) 2 N] 2 S + 2 LiCl
Le [((CH 3 ) 3 Si) 2 N] 2 S réagit avec la combinaison de SCl 2 et de chlorure de sulfuryle (SO 2 Cl 2 ) pour former S 4 N 4 , du chlorure de triméthylsilyle et du dioxyde de soufre :
- 2[((CH 3 ) 3 Si) 2 N] 2 S + 2SCl 2 + 2SO 2 Cl 2 → S 4 N 4 + 8 (CH 3 ) 3 SiCl + 2SO 2
En tant que ligand
Le LiHMDS peut réagir avec une large gamme d' halogénures métalliques , par une réaction de métathèse de sel , pour donner des bis(triméthylsilyl)amides métalliques .
- MX x + x Li(hmds) → M(hmds) x + x LiX
- (X = Cl, Br, I et parfois F)
Les complexes métal bis(triméthylsilyl)amide sont lipophiles en raison du ligand et sont donc solubles dans une gamme de solvants organiques non polaires , ce qui les rend souvent plus réactifs que les halogénures métalliques correspondants, qui peuvent être difficiles à solubiliser. La masse stérique des ligands fait que leurs complexes sont discrets et monomères ; augmentant encore leur réactivité. Ayant une base intégrée, ces composés réagissent commodément avec les précurseurs de ligands protiques pour donner d'autres complexes métalliques et sont donc des précurseurs importants de composés de coordination plus complexes .
Utilisations de niche
LiHMDS est volatil et a été discuté pour une utilisation pour le dépôt de couches atomiques de composés de lithium.
Structure
Comme de nombreux réactifs organolithiens , le lithium bis(triméthylsilyl)amide peut former des agrégats en solution. Le degré d'agrégation dépend du solvant. Dans les solvants de coordination, tels que les éthers et les amines , le monomère et le dimère sont prédominants. A l'état monomère et dimère, une ou deux molécules de solvant se lient aux centres du lithium. Avec l'ammoniac comme base donneuse, le bis(triméthylsilyl)amide de lithium forme un monomère trisolvé qui est stabilisé par des liaisons hydrogène intermoléculaires. Dans les solvants non coordonnants, tels que les aromatiques ou le pentane , les oligomères complexes prédominent, y compris le trimère. Dans la structure à l'état solide est trimérique.

|
||||
 Addit LiHMDS avec TMEDA |
 Dimère solvaté de THF : (LiHMDS) 2 •THF 2 |
 Trimer, sans solvant : (LiHMDS) 3 |
||
Voir également
Les références
- ^ Amonoo-Neizer, EH; Shaw, RA; Skovlin, DO ; Smith, C.-B. (1966). "Lithium Bis(Triméthylsilyl)Amide et Tris(Triméthylsilyl)Amine ". Inorg. Synthé. Synthèses inorganiques. 8 : 19-22. doi : 10.1002/9780470132395.ch6 . ISBN 978-0-470-13239-5.
- ^ un b Danheiser, RL; Miller, RF; Brisbois, RG (1990). "Transfert de groupe diazo détrifluoroacétylatif : ( E )-1-Diazo-4-phényl-3-butène-2-one" . Synthèses organiques . 73 : 134.; Volume collectif , 9 , p. 197
- ^ un b Wu, George; Huang, Mingsheng (juillet 2006). "Réactifs d'organolithium dans les processus asymétriques pharmaceutiques". Critiques chimiques . 106 (7) : 2596–2616. doi : 10.1021/cr040694k . PMID 16836294 .
- ^ Fraser, Robert R.; Mansour, Tarek S. ; Savard, Sylvain (août 1985). « Mesures d'acidité sur les pyridines dans le tétrahydrofurane à l'aide de silylamines lithiées ». Le Journal de Chimie Organique . 50 (17) : 3232-3234. doi : 10.1021/jo00217a050 .
- ^ Maaninen, A.; Shvari, J.; Laitinen, RS; Chivers, T (2002). Coucouvanis, Dimitri (éd.). "Composés d'intérêt général". Synthèses inorganiques . New York : John Wiley & Sons, Inc. 33 : 196-199. doi : 10.1002/0471224502.ch4 .
- ^ Michael Lappert , Andrey Protchenko, Philip Power , Alexandra Seeber (2009). Chimie des amides métalliques . Weinheim : Wiley-VCH. doi : 10.1002/9780470740385 . ISBN 0-470-72184-7.CS1 maint : plusieurs noms : liste des auteurs ( lien )
- ^ Hämäläinen, Jani; Holopainen, Jani; Munnik, Frans; Hatanpää, Timo; Heikkilä, Mikko ; Ritala, Mikko ; Leskelä, Markku (2012). "Films minces de phosphate de lithium cultivés par dépôt de couche atomique". Journal de la société électrochimique . 159 (3) : A259–A263. doi : 10.1149/2.052203jes .
- ^ Lucht, Brett L.; Collum, David B. (1995). « La solvatation éthérée de l'hexaméthyldisilazide de lithium : les relations inattendues du nombre de solvatation, de l'énergie de solvatation et de l'état d'agrégation ». Journal de l'American Chemical Society . 117 (39) : 9863-9874. doi : 10.1021/ja00144a012 .
- ^ un b Lucht, Brett L.; Collum, David B. (1996). « Solvatation d'ions de lithium : Solvats d'amine et d'hydrocarbures insaturés de lithium Hexamethyldisilazide (LiHMDS) ». Journal de l'American Chemical Society . 118 (9) : 2217-2225. doi : 10.1021/ja953029p .
- ^ Neufeld, R.; Michel, R.; Herbst-Irmer, R.; Schöne, R.; Stalke, D. (2016). "L'introduction d'un donneur de liaison hydrogène dans une base de Brønsted faiblement nucléophile: les hexaméthyldisilazides de métaux alcalins (MHMDS, M = Li, Na, K, Rb et Cs) avec de l'ammoniac". Chem. EUR. J. 22 : 12340–12346. doi : 10.1002/chem.201600833 . PMID 27457218 .
- ^ Neufeld, R.: Détermination du poids moléculaire de la courbe d'étalonnage externe DOSY en tant que méthodologie précieuse pour caractériser les intermédiaires réactifs en solution. Dans : eDiss, Georg-August-Universität Göttingen. 2016.
- ^ Rogers, Robin D.; Atwood, Jerry L.; Grüning, Rainer (1978). "La structure cristalline du N- lithiohexaméthyldisilazane, [LiN(SiMe 3 ) 2 ] 3 ". J. Organomet. Chem. 157 (2) : 229-237. doi : 10.1016/S0022-328X(00)92291-5 .

