Physiopathologie de la maladie de Parkinson - Pathophysiology of Parkinson's disease
| Mort neuronale dans le cerveau de la MP | |
|---|---|
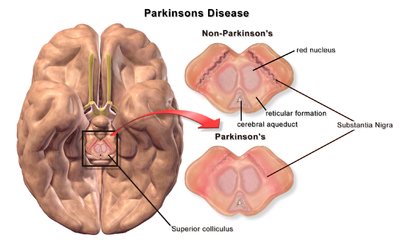 | |
| Un cerveau sans et avec la maladie de Parkinson comparé dans la Substantia Nigra |
La physiopathologie de la maladie de Parkinson est la mort des neurones dopaminergiques à la suite de modifications de l'activité biologique dans le cerveau par rapport à la maladie de Parkinson (MP). Il existe plusieurs mécanismes proposés pour la mort neuronale dans la MP ; cependant, tous ne sont pas bien compris. Cinq mécanismes majeurs proposés pour la mort neuronale dans la maladie de Parkinson comprennent l'agrégation des protéines dans les corps de Lewy , la perturbation de l' autophagie , les modifications du métabolisme cellulaire ou de la fonction mitochondriale , la neuroinflammation et la rupture de la barrière hémato-encéphalique (BHE) entraînant une fuite vasculaire.
Agrégation de protéines
La première cause majeure proposée de mort neuronale dans la maladie de Parkinson est le regroupement, ou l'oligomérisation, de protéines . La protéine alpha-synucléine a une présence accrue dans le cerveau des patients atteints de la maladie de Parkinson et, comme l'alpha-synucléine est insoluble, elle s'agrège pour former des corps de Lewy (illustrés à gauche) dans les neurones. Traditionnellement, les corps de Lewy étaient considérés comme la principale cause de mort cellulaire dans la maladie de Parkinson ; cependant, des études plus récentes suggèrent que les corps de Lewy conduisent à d'autres effets qui provoquent la mort cellulaire. Quoi qu'il en soit, les corps de Lewy sont largement reconnus comme un marqueur pathologique de la maladie de Parkinson.
Les corps de Lewy apparaissent d' abord dans le bulbe olfactif , le bulbe rachidien et le tegmentum pontin ; les patients à ce stade sont asymptomatiques. Au fur et à mesure que la maladie progresse, des corps de Lewy se développent dans la substance noire , les zones du mésencéphale et du cerveau antérieur basal , et dans le néocortex .
Ce mécanisme est étayé par le fait que l'a-synucléine manque de toxicité lorsqu'elle est incapable de former des agrégats ; que les protéines de choc thermique, qui aident au repliement des protéines sensibles à l'agrégation, affectent avantageusement la PD lorsqu'elles sont surexprimées ; et que les réactifs qui neutralisent les espèces agrégées protègent les neurones dans les modèles cellulaires de surexpression de la α-synucléine.
L'alpha-synucléine semble être un lien clé entre la réparation réduite de l' ADN et la maladie de Parkinson. L'alpha-synucléine active l'ATM ( ataxie-télangiectasie mutée), une kinase majeure de signalisation de la réparation des dommages à l'ADN . L'alpha-synucléine se lie aux cassures de l'ADN double brin et facilite le processus de réparation de l'ADN lors de la jonction d'extrémités non homologues . Il a été suggéré que l'agrégation cytoplasmique de l'alpha-synucléine pour former des corps de Lewy réduit ses niveaux nucléaires, entraînant une diminution de la réparation de l'ADN, une augmentation des cassures double brin de l'ADN et une augmentation de la mort cellulaire programmée des neurones .
Perturbation de l'autophagie
Le deuxième mécanisme majeur proposé pour la mort neuronale dans la maladie de Parkinson, l' autophagie , est un mécanisme par lequel les composants internes de la cellule sont décomposés et recyclés pour être utilisés. Il a été démontré que l'autophagie joue un rôle dans la santé du cerveau, en aidant à réguler la fonction cellulaire. La perturbation du mécanisme d'autophagie peut conduire à plusieurs types de maladies comme la maladie de Parkinson.
Il a également été démontré que le dysfonctionnement de l'autophagie dans la maladie de Parkinson entraîne une dégradation dérégulée des mitochondries .
Modifications du métabolisme cellulaire
La troisième cause majeure proposée de mort cellulaire dans la maladie de Parkinson implique l' organite mitochondriale génératrice d'énergie . Dans la maladie de Parkinson, la fonction mitochondriale est perturbée, inhibant la production d'énergie et entraînant la mort.
Le mécanisme derrière le dysfonctionnement mitochondrial dans la maladie de Parkinson est supposé être le complexe PINK1 et Parkin , ayant été démontré qu'il entraîne l'autophagie des mitochondries (également appelée mitophagie ). PINK1 est une protéine normalement transportée dans la mitochondrie, mais peut également s'accumuler à la surface des mitochondries altérées. Le PINK1 accumulé recrute alors Parkin; Parkin initie la décomposition des mitochondries dysfonctionnelles, un mécanisme qui agit comme un "contrôle de qualité" Dans la maladie de Parkinson, on pense que les gènes codant PINK1 et Parkin sont mutés, empêchant ainsi la dégradation des mitochondries altérées, provoquant une fonction et une morphologie anormales des mitochondries et éventuellement la mort cellulaire Il a également été démontré que les mutations de l'ADN mitochondrial (ADNmt) s'accumulent avec l'âge, ce qui indique que la sensibilité à ce mécanisme de mort neuronale augmente avec l'âge.
Un autre mécanisme lié aux mitochondries pour la mort cellulaire dans la maladie de Parkinson est la génération d' espèces réactives de l'oxygène (ROS). Les ROS sont des molécules hautement réactives qui contiennent de l'oxygène et peuvent perturber les fonctions au sein des mitochondries et du reste de la cellule. Avec l'âge, les mitochondries perdent leur capacité à éliminer les ROS tout en maintenant leur production de ROS, provoquant une augmentation de la production nette de ROS et éventuellement la mort cellulaire.
Comme examiné par Puspita et al. des études ont démontré que dans les mitochondries et le réticulum endoplasmique , les niveaux d' alpha-synucléine et de dopamine contribuent probablement au stress oxydatif ainsi qu'aux symptômes de la MP. Le stress oxydatif semble avoir un rôle dans la médiation d'événements pathologiques séparés qui, ensemble, entraînent finalement la mort cellulaire dans la MP. Le stress oxydatif conduisant à la mort cellulaire peut être le dénominateur commun sous-jacent à de multiples processus. Le stress oxydatif provoque des dommages oxydatifs à l'ADN . De tels dommages sont accrus dans les mitochondries de la substance noire des patients parkinsoniens et peuvent conduire à la mort des cellules neuronales nigrales.
Neuroinflammation
Le quatrième mécanisme majeur proposé de mort neuronale dans la maladie de Parkinson, la neuroinflammation , est généralement compris pour les maladies neurodégénératives, cependant, les mécanismes spécifiques ne sont pas complètement caractérisés pour la MP. Un type de cellule majeur impliqué dans la neuroinflammation est la microglie . Les microglies sont reconnus comme les cellules immunitaires innées du système nerveux central . Les microglies surveillent activement leur environnement et modifient considérablement leur morphologie cellulaire en réponse à une lésion neuronale. L'inflammation aiguë dans le cerveau est généralement caractérisée par une activation rapide de la microglie. Pendant cette période, il n'y a pas de réponse immunitaire périphérique. Au fil du temps, cependant, l'inflammation chronique provoque la dégradation des tissus et de la barrière hémato-encéphalique. Pendant ce temps, la microglie génère des espèces réactives de l'oxygène et libère des signaux pour recruter des cellules immunitaires périphériques pour une réponse inflammatoire.
De plus, la microglie est connue pour avoir deux états majeurs : M1, un état dans lequel les cellules sont activées et sécrètent des facteurs pro-inflammatoires ; et M2, un état dans lequel les cellules sont désactivées et sécrètent des facteurs anti-inflammatoires . La microglie est généralement à l'état de repos (M2), mais dans la maladie de Parkinson, elle peut entrer dans M1 en raison de la présence d'agrégats d'-synucléine. La microglie M1 libère des facteurs pro-inflammatoires qui peuvent provoquer la mort des motoneurones. Dans ce cas, les cellules mourantes peuvent libérer des facteurs pour augmenter l'activation de la microglie M1, conduisant à une boucle de rétroaction positive qui provoque une mort cellulaire en augmentation continue.
Ventilation BBB
Le cinquième mécanisme majeur proposé pour la mort cellulaire est la rupture de la barrière hémato-encéphalique (BHE). La BHE possède trois types de cellules qui régulent étroitement le flux de molécules entrant et sortant du cerveau : les cellules endothéliales , les péricytes et les astrocytes . Dans les maladies neurodégénératives, la dégradation de la BHE a été mesurée et identifiée dans des régions spécifiques du cerveau, notamment la substance noire dans la maladie de Parkinson et l' hippocampe dans la maladie d'Alzheimer. Les agrégats de protéines ou les cytokines de la neuroinflammation peuvent interférer avec les récepteurs cellulaires et altérer leur fonction dans la BHE. Plus particulièrement, on pense que le facteur de croissance endothélial vasculaire (VEGF) et les récepteurs du VEGF sont dérégulés dans les maladies neurodégénératives. L'interaction entre la protéine VEGF et ses récepteurs conduit à une prolifération cellulaire, mais serait perturbée dans la maladie de Parkinson et la maladie d'Alzheimer. Cela provoque alors l'arrêt de la croissance des cellules et empêche donc la formation de nouveaux capillaires via l' angiogenèse . La perturbation des récepteurs cellulaires peut également affecter la capacité des cellules à adhérer les unes aux autres avec des jonctions adhérentes .
Sans nouvelle formation capillaire, les capillaires existants se décomposent et les cellules commencent à se dissocier les unes des autres. Cela conduit à son tour à la rupture des jonctions communicantes. Les jonctions lacunaires dans les cellules endothéliales de la BHE aident à empêcher les molécules volumineuses ou nocives de pénétrer dans le cerveau en régulant le flux de nutriments vers le cerveau. Cependant, lorsque les jonctions lacunaires se rompent, les protéines plasmatiques sont capables d'entrer dans la matrice extracellulaire du cerveau. Ce mécanisme est également connu sous le nom de fuite vasculaire, où la dégénérescence capillaire entraîne une « fuite » du sang et des protéines sanguines dans le cerveau. Les fuites vasculaires peuvent éventuellement amener les neurones à modifier leur fonction et à évoluer vers un comportement apoptotique ou la mort cellulaire.
Impact sur la locomotion
Les neurones dopaminergiques sont le type de neurone le plus abondant dans la substance noire , une partie du cerveau régulant le contrôle moteur et l'apprentissage. La dopamine est un neurotransmetteur qui active les motoneurones du système nerveux central . Les motoneurones activés transmettent ensuite leurs signaux, via un potentiel d'action , aux motoneurones des jambes. Cependant, lorsqu'un pourcentage important des motoneurones meurent (environ 50 à 60 %), cela diminue les niveaux de dopamine jusqu'à 80 %. Cela inhibe la capacité des neurones à générer et à transmettre un signal. Cette inhibition de la transmission provoque finalement la démarche parkinsonienne caractéristique avec des symptômes tels que la marche voûtée et ralentie ou des tremblements.






