Proinsuline - Proinsulin
| insuline | |||||||
|---|---|---|---|---|---|---|---|
 L'insuline subit une importante modification post-traductionnelle le long de la voie de production. La production et la sécrétion sont largement indépendantes ; l'insuline préparée est stockée en attente de sécrétion. Le peptide C et l'insuline mature sont tous deux biologiquement actifs. Les composants cellulaires et les protéines de cette image ne sont pas à l'échelle.
| |||||||
| Identifiants | |||||||
| symbole | INS | ||||||
| gène NCBI | 3630 | ||||||
| HGNC | 6081 | ||||||
| OMIM | 176730 | ||||||
| RéfSeq | NM_000207 | ||||||
| UniProt | P01308 | ||||||
| Autre informations | |||||||
| Lieu | Chr. 11 p15.5 | ||||||
| |||||||
La proinsuline est la prohormone précurseur de l' insuline fabriquée dans les cellules bêta des îlots de Langerhans , régions spécialisées du pancréas . Chez l'homme, la proinsuline est codée par le gène INS . Les îlots de Langerhans ne sécrètent qu'entre 1% et 3% de proinsuline intacte. Cependant, comme la proinsuline a une demi-vie plus longue que l'insuline, elle peut représenter entre 5 et 30 % des structures analogues à l'insuline circulant dans le sang. Il existe des concentrations plus élevées de proinsuline après les repas et des niveaux plus faibles lorsqu'une personne est à jeun. De plus, alors que la proinsuline et l'insuline ont des différences structurelles, la proinsuline démontre une certaine affinité pour le récepteur de l' insuline . En raison des similitudes relatives de structure, la proinsuline peut produire entre 5 % et 10 % de l'activité métabolique induite de manière similaire par l'insuline.
La proinsuline est la dernière structure protéique à chaîne unique sécrétée par les cellules avant le clivage en insuline mature. La proinsuline a été découverte par le professeur Donald F. Steiner de l'Université de Chicago en 1967.
Structure
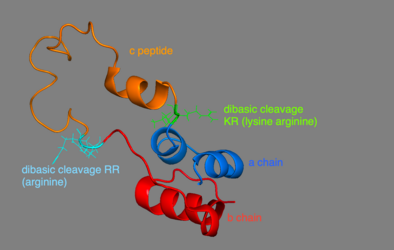
La proinsuline est composée de 86 résidus chez l'homme (81 chez la vache) et formée de trois chaînes distinctes. La chaîne A, la chaîne B et la zone de liaison des deux nommé le peptide C . La structure correcte de la proinsuline est cruciale pour le repliement correct de l'insuline mature, car le placement du peptide C prépare la molécule à créer des liaisons disulfure correctement positionnées dans et entre les chaînes A et B. Il y a trois liaisons disulfure qui sont nécessaires pour que l'insuline mature soit la bonne structure. Deux de ces liaisons disulfure se situent entre les chaînes A et B, et l'une est une liaison intra-chaîne A. Les liaisons disulfure se produisent entre les septièmes résidus de la chaîne A et B, le 20e résidu de la chaîne A et le 19e résidu de la chaîne B, et les 6e et 11e résidus de la chaîne A.
Le peptide C se situe entre les chaînes A et B de la proinsuline. La connexion entre la chaîne A et le peptide C est beaucoup plus stable que la jonction entre le peptide C et la chaîne B, des caractéristiques en hélice alpha étant présentes près de la connexion peptide C-chaîne A. La jonction peptide C-chaîne A se produit entre les résidus 64 et 65 de la proinsuline. Ce sont respectivement des molécules de lysine et d' arginine . La connexion peptide C-chaîne B se situe entre deux résidus arginine aux positions 31 et 32 de la proinsuline.
Il existe une conservation d'une grande partie de la structure de la proinsuline parmi les espèces de mammifères, avec une grande partie des changements de résidus observés d'une espèce à l'autre dans le peptide C. Cela dit, les résidus du peptide C qui sont conservés à travers les espèces interagissent avec des résidus conservés de manière similaire sur les chaînes A et B. Ainsi, il est supposé que ces résidus conservés sont importants pour la fonctionnalité de l'insuline mature.
Synthèse et modification post-traductionnelle
La proinsuline est synthétisée sur les ribosomes associés à la membrane trouvés sur le réticulum endoplasmique rugueux , où elle est repliée et ses liaisons disulfure sont oxydées. Il est ensuite transporté vers l'appareil de Golgi où il est conditionné dans des vésicules de sécrétion, et où il est traité par une série de protéases pour former de l' insuline mature . L'insuline mature a 35 acides aminés de moins ; 4 sont complètement éliminés, et les 31 restants forment le C-peptide . Le peptide C est extrait du centre de la séquence de proinsuline ; les deux autres extrémités (la chaîne B et la chaîne A) restent reliées par des liaisons disulfure.
La modification post-traductionnelle de la proinsuline en insuline mature ne se produit que dans les cellules bêta des îlots de Langerhans. Lorsque la proinsuline est transportée à travers l'appareil de Golgi, le peptide C est clivé. Ce clivage se produit à l'aide de deux endoprotéases. Les endoprotéases de type I , PC1 et PC3, perturbent la connexion entre le peptide C et la chaîne B. PC2, une endoprotéase de type II, clive la liaison de chaîne peptide C-A. La molécule résultante, maintenant l'insuline mature, est stockée sous forme d'hexamère dans des vésicules de sécrétion et est stabilisée avec des ions jusqu'à ce qu'elle soit sécrétée.
Immunogénicité
Lorsque l'insuline a été purifiée à l'origine à partir de pancréas bovin ou porcin , toute la proinsuline n'a pas été complètement éliminée. Lorsque certaines personnes ont utilisé ces insulines, la proinsuline peut avoir provoqué une réaction du corps avec une éruption cutanée, une résistance à l'insuline ou même des bosses ou des bosses dans la peau à l'endroit où l'insuline a été injectée. Ceci peut être décrit comme une lésion iatrogène due à de légères différences entre la proinsuline des différentes espèces. Depuis la fin des années 1970, lorsque l' insuline porcine hautement purifiée a été introduite et que le niveau de pureté de l'insuline a atteint 99 %, cela a cessé d'être un problème clinique important. En ce qui concerne leur influence sur la pharmacocinétique de l' insuline, des concentrations modérées de certains anticorps d'insuline peuvent être un avantage positif à tous les diabétiques sans sécrétion d'insuline endogène (par exemple , les personnes atteintes de diabète de type 1 ) , car les anticorps de liaison à l'insuline augmentent efficacement le taux de clairance de l' insuline et de l' espace de distribution et d' aide prolonger ses demi-vies pharmacologiques et biologiques.
Pertinence médicale
Historiquement, l'accent de nombreuses maladies métaboliques liées à l'insuline s'est concentré sur l'insuline mature. Cependant, ces dernières années, l'importance d'étudier la structure et la fonction de la proinsuline ou du rapport proinsuline:insuline par rapport à ces maladies est devenue de plus en plus claire.
Diabète sucré
Des niveaux accrus de proinsuline dans le système circulatoire par rapport aux concentrations d' insuline mature peuvent indiquer une résistance imminente à l' insuline et le développement d' un diabète de type 2 . Des problèmes supplémentaires avec la proinsuline qui peuvent conduire au diabète incluent des mutations dans le nombre de cystéines présentes, qui pourraient affecter le repliement correct. Si la mutation ne provoque qu'un léger changement, cela pourrait simplement mettre l'accent sur la capacité du réticulum endoplasmique à replier correctement la protéine. Ce stress, au bout d'un certain temps, conduirait à une diminution du nombre de cellules β produisant de l'insuline mature, et conduirait alors au diabète sucré.
Diabète sucré néonatal
La proinsuline postnatale est cruciale pour la régulation métabolique. Cependant, la proinsuline chez les nouveau - nés est importante pour le développement normal des nerfs de l'œil, le développement du cœur et la survie générale des cellules embryonnaires. La régulation de la concentration de proinsuline au cours du développement embryonnaire est cruciale, car trop ou trop peu de peptide peut provoquer des anomalies et la mort du fœtus. Jusqu'à présent, dans l'étude du diabète sucré néonatal, seules les mutations de changement d'acide aminé trouvées dans le domaine B conduisent à la maladie.
Voir également
- insuline
- préproinsuline
- peptide signal
- peptide signal peptidase
- proprotéine convertase 1 (PC1)
- proprotéine convertase 2 (PC2)