Atome de Rydberg - Rydberg atom

Un atome de Rydberg est un atome excité avec un ou plusieurs électrons qui ont un nombre quantique principal très élevé , n . Plus la valeur de n est élevée , plus l'électron est éloigné du noyau, en moyenne . Les atomes de Rydberg ont un certain nombre de propriétés particulières, notamment une réponse exagérée aux champs électriques et magnétiques , de longues périodes de désintégration et des fonctions d'onde d' électrons qui se rapprochent, dans certaines conditions, des orbites classiques des électrons autour des noyaux . Les électrons du noyau protègent le électron externe du champ électrique du noyau de telle sorte que, de loin, le potentiel électrique semble identique à celui éprouvé par l'électron dans un atome d'hydrogène .
Malgré ses défauts, le modèle de Bohr de l'atome est utile pour expliquer ces propriétés. Classiquement, un électron sur une orbite circulaire de rayon r , autour d'un noyau d' hydrogène de charge + e , obéit à la deuxième loi de Newton :
où k = 1 / (4π ε 0 ).
L'impulsion orbitale est quantifiée en unités de ħ :
- .
La combinaison de ces deux équations conduit à l'expression de Bohr pour le rayon orbital en termes du nombre quantique principal , n :
On comprend maintenant pourquoi les atomes de Rydberg ont des propriétés si particulières: le rayon des échelles d'orbite comme n 2 (l'état n = 137 de l'hydrogène a un rayon atomique ~ 1 µm) et la section transversale géométrique comme n 4 . Ainsi, les atomes de Rydberg sont extrêmement grands avec des électrons de valence faiblement liés , facilement perturbés ou ionisés par des collisions ou des champs externes.
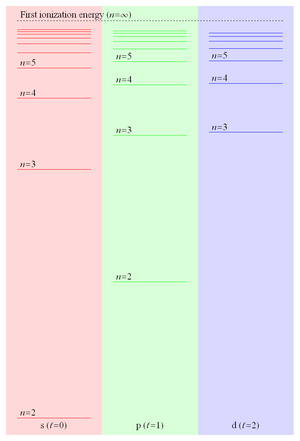
Parce que l' énergie de liaison d'un électron de Rydberg est proportionnelle à 1 / r et tombe donc comme 1 / n 2 , l'espacement des niveaux d'énergie tombe comme 1 / n 3, ce qui conduit à des niveaux de plus en plus rapprochés convergeant sur la première énergie d'ionisation . Ces états de Rydberg étroitement espacés forment ce que l'on appelle communément la série de Rydberg . La figure 2 montre certains des niveaux d'énergie des trois valeurs les plus basses du moment cinétique orbital dans le lithium .
Histoire
L'existence de la série Rydberg a été démontrée pour la première fois en 1885 lorsque Johann Balmer a découvert une formule empirique simple pour les longueurs d' onde de la lumière associées aux transitions dans l' hydrogène atomique . Trois ans plus tard, le physicien suédois Johannes Rydberg a présenté une version généralisée et plus intuitive de la formule de Balmer, connue sous le nom de formule de Rydberg . Cette formule indiquait l'existence d'une série infinie de niveaux d'énergie discrets de plus en plus rapprochés convergeant vers une limite finie.
Cette série a été expliquée qualitativement en 1913 par Niels Bohr avec son modèle semi-classique de l'atome d'hydrogène dans lequel des valeurs quantifiées de moment cinétique conduisent aux niveaux d'énergie discrets observés. Une dérivation quantitative complète du spectre observé a été dérivée par Wolfgang Pauli en 1926 suite au développement de la mécanique quantique par Werner Heisenberg et d'autres.
Méthodes de production
Le seul état véritablement stable d'un atome de type hydrogène est l'état fondamental avec n = 1. L'étude des états de Rydberg nécessite une technique fiable pour exciter les atomes de l'état fondamental vers des états avec une grande valeur de n .
Excitation par impact électronique
De nombreux premiers travaux expérimentaux sur les atomes de Rydberg reposaient sur l'utilisation de faisceaux collimatés d'électrons rapides incident sur des atomes de l'état fondamental. Les processus de diffusion inélastique peuvent utiliser l' énergie cinétique électronique pour augmenter l'énergie interne des atomes excitant à un large éventail d'états différents, y compris de nombreux états de Rydberg de haute altitude,
- .
Parce que l'électron peut conserver n'importe quelle quantité arbitraire de son énergie cinétique initiale, ce processus aboutit toujours à une population avec une large diffusion d'énergies différentes.
Excitation d'échange de charge
Un autre pilier des premières expériences sur l'atome de Rydberg reposait sur l'échange de charges entre un faisceau d' ions et une population d'atomes neutres d'une autre espèce, entraînant la formation d'un faisceau d'atomes hautement excités,
- .
Encore une fois, parce que l'énergie cinétique de l'interaction peut contribuer aux énergies internes finales des constituants, cette technique remplit une large gamme de niveaux d'énergie.
Excitation optique
L'arrivée des lasers à colorant accordables dans les années 1970 a permis un niveau de contrôle beaucoup plus élevé sur les populations d'atomes excités. En excitation optique, le photon incident est absorbé par l'atome cible, spécifiant absolument l'énergie de l'état final. Le problème de la production de populations mono-énergétiques à un seul état d'atomes de Rydberg devient ainsi le problème un peu plus simple du contrôle précis de la fréquence de la sortie laser,
- .
Cette forme d'excitation optique directe est généralement limitée aux expériences avec les métaux alcalins , car l' énergie de liaison à l' état fondamental dans d'autres espèces est généralement trop élevée pour être accessible avec la plupart des systèmes laser.
Pour les atomes avec une grande énergie de liaison d' électrons de valence (équivalente à une grande énergie de première ionisation ), les états excités de la série de Rydberg sont inaccessibles avec les systèmes laser conventionnels. L'excitation collisionnelle initiale peut compenser le manque d'énergie, ce qui permet d'utiliser l'excitation optique pour sélectionner l'état final. Bien que l'étape initiale excite vers une large gamme d'états intermédiaires, la précision inhérente au processus d'excitation optique signifie que la lumière laser n'interagit qu'avec un sous-ensemble spécifique d'atomes dans un état particulier, excitant à l'état final choisi.
Potentiel hydrogène
Un atome dans un état de Rydberg a un électron de valence sur une grande orbite loin du noyau ionique; dans une orbite, l'électron le plus extérieur se sent un tel presque hydrogenic , Coulomb potentiel , U C à partir d' un noyau compact d'ions consistant en un noyau avec Z protons et les couches électroniques inférieures remplies de Z -1 électrons. Un électron dans le potentiel de Coulomb à symétrie sphérique a une énergie potentielle:
- .
La similitude du potentiel effectif «vu» par l'électron externe avec le potentiel d'hydrogène est une caractéristique déterminante des états de Rydberg et explique pourquoi les fonctions d'onde d'électrons se rapprochent des orbites classiques dans la limite du principe de correspondance . En d'autres termes, l'orbite de l'électron ressemble à l'orbite des planètes à l'intérieur d'un système solaire, similaire à ce qui a été vu dans les modèles obsolètes mais visuellement utiles de l'atome de Bohr et Rutherford .
Il existe trois exceptions notables qui peuvent être caractérisées par le terme supplémentaire ajouté à l'énergie potentielle:
- Un atome peut avoir deux (ou plus) électrons dans des états hautement excités avec des rayons orbitaux comparables. Dans ce cas, l'interaction électron-électron donne lieu à un écart important par rapport au potentiel hydrogène. Pour un atome dans un état de Rydberg multiple, le terme supplémentaire, U ee , comprend une sommation de chaque paire d'électrons hautement excités:
- .
- Si l'électron de valence a un moment angulaire très faible (interprété classiquement comme une orbite elliptique extrêmement excentrique ), alors il peut passer suffisamment près pour polariser le noyau ionique, donnant lieu à un terme de polarisation de noyau 1 / r 4 dans le potentiel. L'interaction entre un dipôle induit et la charge qui le produit est toujours attractive donc cette contribution est toujours négative,
- ,
- où α d est la polarisabilité dipolaire . La figure 3 montre comment le terme de polarisation modifie le potentiel à proximité du noyau.
- Si l'électron externe pénètre dans les couches électroniques internes, il «verra» davantage la charge du noyau et subira donc une plus grande force. En général, la modification de l'énergie potentielle n'est pas simple à calculer et doit être basée sur la connaissance de la géométrie du noyau ionique.
Détails mécaniques quantiques
Mécaniquement quantique, un état avec n anormalement élevé fait référence à un atome dans lequel le ou les électrons de valence ont été excités dans une orbitale d'électrons autrefois non peuplée avec une énergie plus élevée et une énergie de liaison inférieure . Dans l'hydrogène, l'énergie de liaison est donnée par:
- ,
où Ry = 13,6 eV est la constante de Rydberg . La faible énergie de liaison à des valeurs élevées de n explique pourquoi les états de Rydberg sont sensibles à l'ionisation.
Des termes supplémentaires dans l'expression d'énergie potentielle pour un état de Rydberg, en plus de l'énergie potentielle hydrogénée de Coulomb, nécessitent l'introduction d'un défaut quantique , δ l , dans l'expression de l'énergie de liaison:
- .
Fonctions d'onde électronique
Les longues durées de vie des états de Rydberg avec un moment angulaire orbital élevé peuvent être expliquées en termes de chevauchement des fonctions d'onde. La fonction d'onde d'un électron dans un état l élevé (moment angulaire élevé, «orbite circulaire») a très peu de chevauchement avec les fonctions d'onde des électrons internes et reste donc relativement imperturbable.
Les trois exceptions à la définition d'un atome de Rydberg comme un atome à potentiel hydrogène, ont une description alternative, mécanique quantique, qui peut être caractérisée par le (s) terme (s) supplémentaire (s) dans l' hamiltonien atomique :
- Si un deuxième électron est excité dans un état n i , énergétiquement proche de l'état de l'électron externe n o , alors sa fonction d'onde devient presque aussi grande que le premier (un double état de Rydberg). Cela se produit lorsque n i s'approche de n o et conduit à une condition dans laquelle la taille des orbites des deux électrons est liée; une condition parfois appelée corrélation radiale . Un terme de répulsion électron-électron doit être inclus dans l'hamiltonien atomique.
- La polarisation du noyau ionique produit un potentiel anisotrope qui provoque une corrélation angulaire entre les mouvements des deux électrons les plus externes. Cela peut être considéré comme un effet de blocage de marée dû à un potentiel à symétrie non sphérique. Un terme de polarisation de noyau doit être inclus dans l'hamiltonien atomique.
- La fonction d'onde de l'électron externe dans les états à faible moment angulaire orbital l , est périodiquement localisée dans les coquilles d'électrons internes et interagit avec la pleine charge du noyau. La figure 4 montre une interprétation semi-classique des états de moment cinétique dans une orbitale électronique, illustrant que les états low- l passent plus près du noyau pénétrant potentiellement dans le noyau ionique. Un terme de pénétration du noyau doit être ajouté à l'hamiltonien atomique.
Dans les domaines externes
La grande séparation entre l'électron et le noyau ionique dans un atome de Rydberg rend possible un moment dipolaire électrique extrêmement important , d . Il y a une énergie associée à la présence d'un dipôle électrique dans un champ électrique , F , connu en physique atomique sous le nom de décalage de Stark ,
En fonction du signe de la projection du moment dipolaire sur le vecteur de champ électrique local, un état peut avoir une énergie qui augmente ou diminue avec l'intensité du champ (états de recherche de champ bas et haut respectivement). L'espacement étroit entre les n niveaux adjacents dans la série de Rydberg signifie que les états peuvent s'approcher de la dégénérescence même pour des intensités de champ relativement modestes. L'intensité de champ théorique à laquelle un croisement se produirait en supposant qu'il n'y a pas de couplage entre les états est donnée par la limite d'Inglis – Teller ,
Dans l' atome d'hydrogène , le potentiel Coulomb 1 / r pur ne couple pas les états de Stark provenant de n- variétés adjacentes, ce qui entraîne des croisements réels comme le montre la figure 5 . La présence de termes supplémentaires dans l'énergie potentielle peut conduire à un couplage entraînant des croisements évités comme le montre le lithium sur la figure 6 .
Applications et recherches complémentaires
Mesures de précision des atomes de Rydberg piégés
Les durées de vie de désintégration radiative des atomes dans des états métastables à l'état fondamental sont importantes pour comprendre les observations astrophysiques et les tests du modèle standard.
Étude des effets diamagnétiques
Les grandes dimensions et de faibles énergies de liaison des atomes de Rydberg conduisent à une forte susceptibilité magnétique , . Comme les effets diamagnétiques échelonnent avec l'aire de l'orbite et que l'aire est proportionnelle au rayon au carré ( A ∝ n 4 ), les effets impossibles à détecter dans les atomes de l'état fondamental deviennent évidents dans les atomes de Rydberg, qui démontrent de très grands déplacements diamagnétiques.
Les atomes de Rydberg présentent un fort couplage dipolaire électrique des atomes aux champs électromagnétiques et ont été utilisés pour détecter les communications radio.
Dans les plasmas
Les atomes de Rydberg se forment couramment dans les plasmas en raison de la recombinaison d'électrons et d'ions positifs; la recombinaison à faible énergie donne des atomes de Rydberg assez stables, tandis que la recombinaison d'électrons et d'ions positifs avec une énergie cinétique élevée forme souvent des états de Rydberg auto-ionisants . La grande taille des atomes de Rydberg et leur susceptibilité à la perturbation et à l'ionisation par les champs électriques et magnétiques sont un facteur important déterminant les propriétés des plasmas.
La condensation des atomes de Rydberg forme la matière de Rydberg , le plus souvent observée sous forme d'amas de longue durée. La désexcitation est considérablement entravée dans la matière de Rydberg par des effets de corrélation d'échange dans le liquide électronique non uniforme formé lors de la condensation par les électrons de valence collective, ce qui entraîne une durée de vie prolongée des amas.
En astrophysique
Il a été suggéré que les atomes de Rydberg sont communs dans l'espace interstellaire et pourraient être observés depuis la Terre. Étant donné que la densité dans les nuages de gaz interstellaires est de plusieurs ordres de grandeur inférieure aux meilleurs aspirateurs de laboratoire disponibles sur Terre, les états de Rydberg pourraient persister pendant de longues périodes sans être détruits par des collisions.
Systèmes fortement interactifs
En raison de leur grande taille, les atomes de Rydberg peuvent présenter des moments dipolaires électriques très importants . Les calculs utilisant la théorie des perturbations montrent qu'il en résulte de fortes interactions entre deux atomes de Rydberg proches. Le contrôle cohérent de ces interactions combiné à leur durée de vie relativement longue en fait un candidat approprié pour réaliser un ordinateur quantique . En 2010, des portes de deux qubits ont été réalisées expérimentalement. Les atomes de Rydberg en interaction forte présentent également un comportement critique quantique , ce qui les rend intéressants à étudier seuls.
Orientations actuelles de la recherche
Depuis les années 2000, la recherche sur les atomes de Rydberg englobe trois directions: la détection, l'optique quantique, le calcul quantique et la simulation quantique . Les moments dipolaires électriques élevés entre les états atomiques de Rydberg sont utilisés pour la détection et l'imagerie radiofréquence et térahertz , y compris les mesures de non-démolition de photons micro-ondes individuels. La transparence induite électromagnétiquement a été utilisée en combinaison avec de fortes interactions entre deux atomes excités dans l'état de Rydberg pour fournir un milieu qui présente un comportement fortement non linéaire au niveau des photons optiques individuels. L'interaction accordable entre les états de Rydberg a également permis les premières expériences de simulation quantique.
En octobre 2018, le laboratoire de recherche de l'armée des États-Unis a discuté publiquement des efforts visant à développer un récepteur radio super large bande utilisant des atomes de Rydberg. En mars 2020, le laboratoire a annoncé que ses scientifiques avaient analysé la sensibilité du capteur Rydberg aux champs électriques oscillants sur une énorme gamme de fréquences - de 0 à 10 ^ 12 Hertz (le spectre à une longueur d'onde de 0,3 mm). Le capteur Rydberg peut détecter de manière fiable les signaux sur tout le spectre et se comparer favorablement avec d'autres technologies de capteur de champ électrique établies, telles que les cristaux électro-optiques et l'électronique passive couplée à une antenne dipôle.
Simulation classique

Un simple potentiel 1 / r se traduit par une orbite elliptique képlérienne fermée . En présence d'un champ électrique externe, les atomes de Rydberg peuvent obtenir des moments dipolaires électriques très importants les rendant extrêmement sensibles aux perturbations par le champ. La figure 7 montre comment l'application d'un champ électrique externe (connu en physique atomique sous le nom de champ de Stark ) modifie la géométrie du potentiel, modifiant considérablement le comportement de l'électron. Un potentiel coulombique n'applique aucun couple car la force est toujours antiparallèle au vecteur de position (pointant toujours le long d'une ligne passant entre l'électron et le noyau):
- ,
- .
Avec l'application d'un champ électrique statique, l'électron ressent un couple en constante évolution. La trajectoire qui en résulte devient progressivement plus déformée au fil du temps, passant finalement par la gamme complète du moment cinétique de L = L MAX , à une ligne droite L = 0, à l'orbite initiale dans le sens opposé L = - L MAX .
La période de temps de l'oscillation du moment angulaire (le temps nécessaire pour terminer la trajectoire de la figure 8 ) correspond presque exactement à la période prédite mécaniquement quantique pour que la fonction d'onde revienne à son état initial, démontrant la nature classique de l'atome de Rydberg.
Voir également
- Système Rydberg lourd
- Ancienne théorie quantique
- Chaos quantique
- Molécule de Rydberg
- Polaron de Rydberg