Glycoside de stéviol - Steviol glycoside
Les glycosides de stéviol sont les composés chimiques responsables du goût sucré des feuilles de la plante sud-américaine Stevia rebaudiana ( Asteraceae ) et les principaux ingrédients (ou précurseurs ) de nombreux édulcorants commercialisés sous le nom générique de stevia et sous plusieurs noms commerciaux . Ils sont également présents dans l'espèce apparentée Stevia phlebophylla (mais dans aucune autre espèce de Stevia ) et dans la plante Rubus chingii ( Rosaceae ).
Les glycosides de stéviol de Stevia rebaudiana ont été signalés comme étant entre 30 et 320 fois plus sucrés que le saccharose, bien qu'il y ait un certain désaccord dans la littérature technique à propos de ces chiffres. Ils sont stables à la chaleur, au pH stable et ne fermentent pas .
Les glycosides de stéviol n'induisent pas de réponse glycémique lorsqu'ils sont ingérés, car les humains ne peuvent pas métaboliser la stévia. La dose journalière acceptable (DJA) pour les glycosides de stéviol, exprimée en équivalents de stéviol, a été établie à 4 mg / kg de poids corporel / jour, et est basée sur aucun effet observé d'une dose 100 fois plus élevée dans une étude chez le rat.
Structure
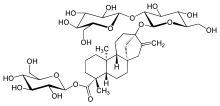
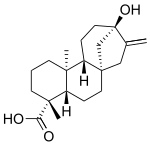
Ces composés sont des glycosides de stéviol , un composé diterpénique . Plus précisément, leurs molécules peuvent être considérées comme une molécule de stéviol, avec son atome d' hydrogène carboxyle remplacé par une molécule de glucose pour former un ester , et un hydrogène hydroxyle avec des combinaisons de glucose et de rhamnose pour former un acétal .
Les glycosides de stéviol trouvés dans les feuilles de S. rebaudiana et leur pourcentage en poids comprennent:
- Stevioside (5 à 10%)
- Rebaudioside A (2 à 4%)
- Rébaudioside C (1 à 2%)
- Dulcoside A (0,5–1%)
- Rébaudioside B
- Rébaudioside D
- Rébaudioside E
Les trois derniers ne sont présents qu'en quantités infimes, et le rébaudioside B a été revendiqué comme étant un sous-produit de la technique d'isolement. Un mélange commercial de glycoside de stéviol extrait de la plante s'est avéré contenir environ 80% de stévioside, 8% de rébaudioside A et 0,6% de rébaudioside C.
La plante chinoise Rubus chingii produit du rubusoside, un glycoside de stéviol que l'on ne trouve pas dans la stévia .
Le stévioside et le rébaudioside A ont été isolés pour la première fois en 1931 par les chimistes français Bridel et Lavielle. Les deux composés n'ont que des sous-groupes de glucose: le stévioside a deux molécules de glucose liées au site hydroxyle, tandis que le rébaudioside A en a trois, le glucose moyen du triplet étant connecté à la structure centrale du stéviol.
Les premiers tests sensoriels ont conduit à affirmer que le rébaudioside A était 150 à 320 fois plus sucré que le saccharose, le stévioside 10 à 270 fois plus sucré, le rébaudioside C 40 à 60 fois plus sucré et le dulcoside A 30 fois plus sucré. Cependant, une évaluation plus récente a révélé que le rebaudoside A était environ 240 fois plus sucré et le stévioside environ 140 fois. Le rébaudioside A avait également le moins d'amertume et d'arrière-goût. La douceur relative semble varier avec la concentration: un mélange de glycosides de stéviol dans les proportions naturelles s'est avéré 150 fois plus sucré que le saccharose lorsqu'il correspond à une solution de saccharose à 3%, mais seulement 100 fois plus sucré lorsqu'il correspond à une solution de saccharose à 10%.
Biosynthèse
Chez Stevia rebaudiana , la biosynthèse des glucosides n'a lieu que dans les tissus verts. Le stéviol est d'abord produit dans les plastes et dans le réticulum endoplasmique est glucosylé et glycosylé dans le cytoplasme , catalysé par les UDP- glucosyltransférases . Le rébaudioside A, en particulier, est formé à partir du stévioside .
Bien qu'il existe plusieurs molécules qui entrent dans la catégorie du glycoside de stéviol, la synthèse suit une voie similaire. La synthèse du glycoside de stéviol commence par des unités isoprène créées via la voie DXP ou MEP . Deux molécules dérivées du métabolisme primaire , le pyruvate et le glycéraldéhyde 3-phosphate , sont les molécules initiales de cette voie.
Lors de la formation de l'IPP et du DMAPP , le diterpène GGPP est formé par addition tête-à-queue par un mécanisme Sn1 . L'allongement commence lorsque l'IPP et le DMAPP forment le pyrophosphate de géranyle (GPP). Le GPP s'allonge grâce au même mécanisme Sn1 pour créer du Farnesyl Pyrophosphate (FPP) et le FPP s'allonge pour former le GGPP.
Avec la formation de la GGPP, la cyclisation se produit par les enzymes copalyldiphosphate synthase (CDPS) et Kuarène Synthase (KS) pour former - (-) Kuarène. Plusieurs étapes d' oxydation se produisent alors pour former du stéviol.
La biosynthèse du glycoside de stéviol suit ensuite plusieurs modifications du stéviol qui sélectionnent de manière régiosélective les molécules de sucre à placer. Une fois ces molécules totalement glycosylées, les glycosides sont ensuite stockés dans des vacuoles .
Voir également
Les références
- ^ A b c d e Brandle, JE; Telmer, PG (2007). "Biosynthèse de glycoside de stéviol" (PDF) . Phytochimie . 68 (14): 1855–1863. doi : 10.1016 / j.phytochem.2007.02.010 . PMID 17397883 . Archivé de l'original (PDF) le 2017-08-10.
- ^ a b c d e Brandle, JE; Starratt, AN; Gijzen, M. (1998). "Stevia rebaudiana: Ses propriétés agricoles, biologiques et chimiques" . Revue canadienne de la phytologie . 78 (4): 527-536. doi : 10.4141 / P97-114 .
- ^ A b c H.MAB Cardello, MAPA Da Silva, MH Damasio (1999). "Mesure de la douceur relative de l'extrait de stévia, de l'aspartame et du mélange cyclamate / saccharine par rapport au saccharose à différentes concentrations". Aliments végétaux pour la nutrition humaine . 54 (2): 119-129. doi : 10.1023 / A: 1008134420339 . PMID 10646559 . S2CID 38718610 . CS1 maint: utilise le paramètre auteurs ( lien )
- ^ Geuns, JM; Buyse, J; Vankeirsbilck, A; Temme, EH; Compernolle, F; Toppet, S (5 avril 2006). "Identification du glucuronide de stéviol dans l'urine humaine" . Journal de chimie agricole et alimentaire . 54 (7): 2794–8. doi : 10.1021 / jf052693e . PMID 16569078 .
- ^ Samuel P, Ayoob KT, Magnuson BA, Mathews R (2018). "Feuille de Stevia à l'édulcorant de Stevia: Exploration de sa science, avantages et potentiel futur" . Journal de la nutrition . 148 (7): 1186S – 1205S. doi : 10.1093 / jn / nxy102 . PMID 29982648 .
-
^ Groupe de l' EFSA sur les additifs alimentaires et les sources de nutriments ajoutés aux aliments (ANS) (2010). "Avis scientifique sur la sécurité des glycosides de stéviol pour les utilisations proposées comme additif alimentaire" . Journal de l'EFSA . 8 (4): 1537. doi : 10.2903 / j.efsa.2010.1537 .

- ^ Bridel, M .; Lavielle, R. (1931). "Sur le principe sucré des feuilles de Kaâ-hê-é (stevia rebaundiana B)" . Comptes rendus de l'Académie des sciences (Parties 192): 1123–1125.
- ^ Huxtable, RJ, 2002. Pharmacologie et toxicologie du stévioside, du rébaudioside A et du stéviol. Dans: Kinghorn, AD (Ed.), Stevia: The Genus Stevia. Taylor et Francis, Londres et New York, pp.160–177.
- ^ Lichtenhalter, HK, 1999. La voie 1-désoxy-D-xylulose-5-phosphate de la biosynthèse des isoprénoïdes dans les plantes. Annu. Rev. Plant Physiol. PlantMol. Biol. 50, 47–65.
- ^ Totté, N., Charon, L., Rohmer, M., Compernolle, F., Baboeuf, I., Geuns, JMC, 2000. Biosynthèse du diterpénoïde steviol, un dérivé ent-kaurène de Stevia rebaudiana Bertoni, via le voie du phosphate de méthylérythritol Tetrahedron Letters 41, 6407–6410
- ^ Richman, AS, Gijzen, M., Starratt, AN, Yang, Z., Brandle, JE, 1999. Synthèse de diterpène dans Stevia rebaudiana: recrutement et régulation positive des enzymes clés de la voie de biosynthèse de la gibbérelline The Plant Journal 19, 411– 421.
- ^ Richman, A., Swanson, A., Humphrey, T., Chapman, R., McGarvey, B., Pocs, R., Brandle, J., 2005. La génomique fonctionnelle découvre trois glucosyltransférases impliquées dans la synthèse des principaux glucosides sucrés de Stevia rebaudiana Plant J. 41, 56–67
Liens externes
-
 Médias liés aux glycosides de stéviol sur Wikimedia Commons
Médias liés aux glycosides de stéviol sur Wikimedia Commons