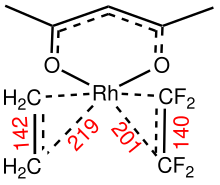Complexe d'alcène de métal de transition - Transition metal alkene complex
En chimie organométallique , un complexe alcène de métal de transition est un composé de coordination contenant un ou plusieurs ligands alcènes . Ces composés sont des intermédiaires dans de nombreuses réactions catalytiques qui convertissent les alcènes en d'autres produits organiques.
Les mono- et dialcènes sont souvent utilisés comme ligands dans des complexes stables.
Monoalcènes
Le monoalcène le plus simple est l' éthylène . De nombreux complexes d'éthylène sont connus, dont le sel de Zeise (voir figure), Rh 2 Cl 2 (C 2 H 4 ) 4 , Cp* 2 Ti(C 2 H 4 ), et l'homoleptique Ni(C 2 H 4 ) 3 . Les monoalcènes substitués comprennent le cyclooctène cyclique , tel que trouvé dans le dimère de chlorobis(cyclooctène)rhodium . Les alcènes avec des groupes électroattracteurs se lient généralement fortement aux métaux de faible valence. Des exemples de tels ligands sont le TCNE , le tétrafluoroéthylène , l' anhydride maléique et les esters d' acide fumarique . Ces accepteurs forment des adduits avec de nombreux métaux de valence zéro.
Diènes, triènes, polyènes, céto-alcènes et autres ligands alcènes compliqués
Le butadiène , le cyclooctadiène et le norbornadiène sont des agents chélatants bien étudiés. Les triènes et même certains tétraènes peuvent se lier aux métaux via plusieurs centres carbonés adjacents. Des exemples courants de tels ligands sont le cycloheptatriène et le cyclooctatetraène . Le collage est souvent noté en utilisant le formalisme de l' hapticité . Les céto-alcènes sont des ligands tétrahapto qui stabilisent les métaux à faible valence hautement insaturés tels que trouvés dans le (benzylidèneacétone)fer tricarbonyle et le tris(dibenzylidèneacétone)dipalladium(0) .
- Complexes d'alcènes métalliques.
Bis(cyclooctadiène)nickel(0) , un catalyseur et une source de « nickel nu ».
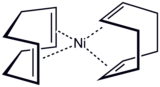
Le premier complexe alcène, l'anion du sel de Zeise .
Dimère de Chlorobis(cyclooctène)rhodium , source de "RhCl".
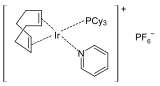
Le catalyseur de Crabtree , un catalyseur très actif pour l'hydrogénation.
[[Et 3 P] 2 Pt] 6 (η 2 :η 2 :η 2 :η 2 :η 2 :η 2 -C 60 ), un complexe de fullerène .
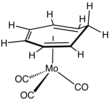
Mo(C 7 H 8 )(CO) 3 , un complexe de cycloheptatriène .
Fe(C 8 H 8 ) 2 , un complexe de cyclooctatétraène
(Norbornadiène)molybdène tétracarbonyle , une source de "Mo(CO) 4 "
( Xylylène )Fe(CO) 3 , illustrant la stabilisation d'un alcène labile par complexation
Collage
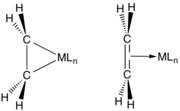
La liaison entre les alcènes et les métaux de transition est décrite par le modèle Dewar-Chatt-Duncanson , qui implique le don d'électrons dans l'orbitale pi sur l'alcène aux orbitales vides sur le métal. Cette interaction est renforcée par une liaison arrière qui implique le partage d'électrons dans d'autres orbitales métalliques dans le niveau d'anti-liaison pi vide sur l'alcène. Les premiers métaux à faible degré d'oxydation (Ti(II), Zr(II), Nb(III) etc.) sont de puissants donneurs de pi, et leurs complexes alcènes sont souvent décrits comme des métallacyclopropanes. Le traitement de ces espèces avec des acides donne les alcanes. Les métaux tardifs (Ir(I), Pt(II)), qui sont des pi-donneurs plus pauvres, ont tendance à engager l'alcène en tant qu'interaction acide de Lewis - base de Lewis . De même, C 2 F 4 est un pi-accepteur plus fort que C 2 H 4 , comme le reflètent les distances de liaison métal-carbone.
- Coller des images
Interactions orbitales dans un complexe métal-éthylène, telles que décrites par le modèle Dewar-Chatt-Duncanson
Barrière de rotation
La barrière pour la rotation de l'alcène autour du vecteur centroïde M est une mesure de la force de la liaison pi M-alcène. Les complexes à faible symétrie conviennent à l'analyse de ces barrières rotationnelles associées à la liaison métal-éthylène. Dans Cp Rh(C 2 H 4 )(C 2 F 4 ), le ligand éthylène tourne avec une barrière proche de 12 kcal/mol mais aucune rotation n'est observée pour la liaison Rh-C 2 F 4 environ .
Réactions et applications
Les ligands alcènes perdent une grande partie de leur caractère insaturé lors de la complexation. Le plus célèbre est que le ligand alcène subit une insertion migratoire , dans laquelle il est attaqué de manière intramoléculaire par des ligands alkyle et hydrure pour former de nouveaux complexes alkyle. Les complexes alcènes cationiques sont susceptibles d'être attaqués par les nucléophiles.
Catalyse
Les complexes d'alcènes métalliques sont des intermédiaires dans de nombreuses ou la plupart des réactions d'alcènes catalysées par des métaux de transition : polymérisation , hydrogénation , hydroformylation et de nombreuses autres réactions.
Séparations
Étant donné que les alcènes sont principalement produits sous forme de mélanges avec des alcanes, la séparation des alcanes et des alcènes présente un intérêt commercial. Les technologies de séparation reposent souvent sur des membranes de transport facilité contenant des sels Ag + ou Cu + qui se lient de manière réversible aux alcènes.
En chromatographie d'argentation , des phases stationnaires contenant des sels d'argent sont utilisées pour analyser les composés organiques sur la base du nombre et du type de groupes alcènes (oléfines). Cette méthodologie est couramment utilisée pour l'analyse de la teneur en matières insaturées des graisses et des acides gras .
Occurrence naturelle
Les complexes métal-alcène sont rares dans la nature, à une exception près. L'éthylène affecte la maturation des fruits et des fleurs par complexation en un centre Cu(I) dans un facteur de transcription .
Les références
- ^ A b c Elschenbroich, C. « Organometallics » (2006) Wiley-VCH: Weinheim. ISBN 3-527-29390-6
- ^ un b Evans, JA; Russell, DR (1971). « Les structures cristallines des complexes d'éthylène et de tétrafluoroéthylène du rhodium (I) ». Journal of the Chemical Society D : Chemical Communications : 197. doi : 10.1039/C29710000197 .
- ^ Cramer, Richard; Kline, Jules B. ; Roberts, John D. (1969). "Caractère de liaison et équilibrage conformationnel des complexes d'éthylène et de tétrafluoroéthylènerhodium à partir des spectres de résonance magnétique nucléaire". Journal de l'American Chemical Society . 91 (10) : 2519-2524. doi : 10.1021/ja01038a021 .
- ^ Piet WNM van Leeuwen « Catalyse homogène : Comprendre l'art », 2004, Wiley-VCH, Weinheim. ISBN 1-4020-2000-7
- ^ Azhin, Maryam; Kaghazchi, Tahereh ; Rahmani, Mohamed (2008). "Un examen sur la séparation oléfine/paraffine utilisant la technologie de complexation chimique réversible". Journal de chimie industrielle et technique . 14 (5) : 622-638. doi : 10.1016/j.jiec.2008.04.014 .
- ^ Boryana Nikolova-Damyanova. « Principes de la complexation des ions d'argent avec des doubles liaisons » .
- ^ Jose M. Alonso, Anna N. Stepanova "La voie de signalisation d'éthylène" Science 2004, Vol. 306, pages 1513-1515. doi : 10.1126/science.1104812